Enslyon.free.fr
Rapport de Stage
De
Mathieu GINESTE
Maître de Stage :
Michel Pucéat
Equipe Cellules ES et Différenciation cardiaque
CRBM CNRS FRE2593
1919 route de mende
34293 MONTPELLIER, France
Sujet du Stage :
Oct-4 module la spécification puis la différenciation des
cellules souches embryonnaires vers un phénotype cardiaque.
Oct-4 module la spécification puis la différenciation des cellules souches
embryonnaires vers un phénotype cardiaque.
Résumé
Oct-4 est un des facteurs de transcription les plus précocement exprimés au cours du développement
embryonnaire et est reconnu pour son rôle dans la maintenance de la pluripotence des cellules ES. Nous
démontrons dans cette étude le rôle d'Oct-4 dans la différenciation cellulaire, et plus précisément dans la
différenciation cellulaire cardiaque. Nous montrons d'abord, in vitro et in vivo, que l'expression d'Oct-4 est
modulée par Nodal, un facteur précoce inducteur du mésoderme. Nous montrons ensuite que la
surexpression d'Oct-4 résulte en une spécification puis une différenciation cardiaque des cellules ES.
Nous montrons enfin que l'inhibition du pic d'expression transitoire d'Oct-4 se traduit par des anomalies
de développement. Ces résultats suggèrent ainsi qu'Oct-4 régule l'expression de ses gènes cibles de
manière dose-dépendante. Introduction
Une étape indispensable dans l'approche
intégrative pour comprendre le rôle de Oct-4
in
Les cellules souches embryonnaires (cellules ES),
vivo est l'établissement de son profil d'expression
issues de la masse interne du blastocyste, se lors des premiers jours du développement caractérisent par leur capacité à s'autorenouveler
embryonnaire. A cet effet, des blastocystes âgés de
et à se différencier en n'importe quel type 4,5 jours (pc) ont été collectés à partir de souris cellulaire de l'organisme adulte. De nombreux gestantes et mis en culture pendant 5 jours en travaux ont tenté de définir les bases moléculaires
présence de 100 ng/mL de SCF. Le taux
de l'état particulier de ces cellules ES, souvent d'expression de Oct-4 est évalué par RT-qPCR qualifié de «
». Ainsi Oct-4 a été [
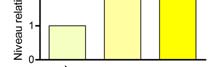
Fig. 1]. La quantité d'ARNm codant pour Oct-4
identifié comme un facteur de transcription atteint un pic d'expression à 6,5 jours (pc) puis précoce au cours du développement embryonnaire
chute très rapidement.
intervenant dans la maintenance de la pluripotence cellulaire : l'inhibition de l'expression d'Oct-4 entraîne la perte de la pluripotence des cellules ES, puis leur différenciation vers le trophectoderme [Nichols et al. 1998]. Cependant, d'autres résultats tendent également à suggérer l'implication d'Oct-4 dans des phénomènes de différenciation cellulaire : la surexpression d'Oct-4, maintenue
pendant plusieurs jours, entraîne la différenciation
des cellules ES vers l'endoderme primitif et/ou le
Fig. 1 : Oct-4 présente un pic d'expression vers le jour
6,5 (pc). Résultats d'analyse d'expression par RT-qPCR.
mésoderme [Niwa et al. 2000].
Le taux d'expression de Oct-4 est normalisé par rapport au
Les présents travaux se placent dans la continuité
taux d'expression de la tubuline. Le niveau relatif
d'expression est calculé en prenant comme référence le taux
de ces observations et tentent d'aller au-delà en
d'expression dans les blastocystes nouvellement prélevés.
démontrant un rôle d'Oct-4 dans la différenciation
Chaque point correspond à au moins six blastocystes.
cellulaire cardiaque. Une première série
d'expériences d'induction montre que l'expression
Nodal induit l'expression de Oct-4 in vitro.
d'Oct-4 au cours du développement embryonnaire
est régulée par le facteur Nodal, un inducteur du
Nodal est le facteur de la famille des TGF-β le
mésoderme. Une deuxième série d'expériences plus précocement exprimé lors du développement modulant l'expression
d'Oct-4
in vitro et
in vivo
embryonnaire. En plus d'intervenir dans
démontre un rôle spécifique d'Oct-4 dans la l'établissement des axes embryonnaires, il spécification, puis la différenciation cardiaque.
participe à l'induction du mésendoderme chez les
Vertébrés et en particulier du mésoderme
Résultats
cardiaque [Conlon et al. 1994, Zhou et al. 1993].
Afin de déterminer si Nodal module l'expression
Oct-4 présente un pic d'expression au cours des
de Oct-4, des cellules CGR8 ont été mises en
premiers jours du développement embryonnaire.
culture pendant 48h en présence de LIF et de



différentes concentrations du facteur Nodal. Le On remarque une différence dans l'intensité, dans taux d'expression de Oct-4 est évalué par RT-
l'étendue et dans la persistance de la fluorescence :
qPCR [Fig. 2].
Oct-4 est plus fortement et plus longtemps
exprimé dans les blastocystes en présence de Nodal. On remarque également que l'intensité et l'étendue de la fluorescence sont maximales au jour 3 et en présence de Nodal. On note enfin la présence de corps apoptotiques au jour 4 et en absence de Nodal
: cette observation est
probablement à raccorder avec la faible quantité de Oct-4 compromettant la viabilité du blastocyste.
Fig. 2 : Nodal induit l'expression de Oct-4 in vitro.
Résultats d'analyse d'expression par RT-qPCR en absence
La voie de signalisation canonique des facteurs de
(Control) ou en présence de Nodal (10 ou 50ng/mL). On
notera l'absence de linéarité entre le taux d'expression de
la famille des TGF-β est la voie des Smads. La
Oct-4 et la concentration de Nodal. Le taux d'expression de
fixation de Nodal sur son récepteur provoque la
Oct-4 est normalisé par rapport au taux d'expression de la
tubuline. Le niveau relatif d'expression est calculé en prenant
phosphorylation de Smad2 puis son association
comme référence le taux d'expression en absence de Nodal.
avec Smad4 et d'autres facteurs transcription
[Kumar et al. 2001, Lee et al. 2001, Yeo &
On remarque que Nodal induit une augmentation
Whitman 2001], permettant ainsi la régulation de
de l'expression de Oct-4. Cette augmentation en
différents gènes.
présence de Nodal est du même ordre de grandeur
Afin de confirmer l'implication des facteurs de la
que celle obtenue in vivo (cf. Fig. 1) : ×3,2 pour
famille des TGF-β dans l'activation de Oct-4 par
10ng/mL et ×4,5 pour 50ng/mL.
l'intermédiaire de Smad2, une caractérisation des
facteurs se liant au promoteur de Oct-4 s'avère
Nodal induit l'expression de Oct-4 in vivo.
judicieuse. A cet effet, une immuno-précipitation
de chromatine a été réalisée en utilisant un
Afin de valider in vivo les résultats précédents, des
anticorps anti-Smad4 sur des cellules mises en
blastocystes âgés de 4,5 jours ont été collectés à
culture en absence ou présence de TGF-β pendant
partir de souris transgéniques, possédant le gène
48h. Les fragments d'ADN obtenus après
codant pour la GFP sous le contrôle du promoteur
immuno-précipitation ont été quantifiés par RT-
d'Oct-4, puis mis en culture sur lame Labtek® en
qPCR et ont ensuite été analysés par
présence de Nodal. Le taux d'expression d'Oct-4
électrophorèse [Fig .4].
est évalué par l'étendue du territoire cellulaire
fluorescent [Fig. 3].
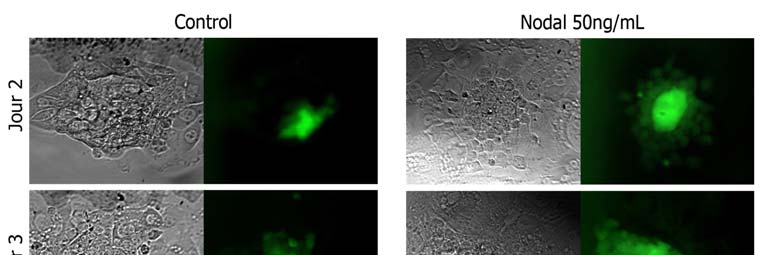
Fig. 3 : Nodal induit l'expression
de Oct-4 in vivo. Blastocystes
après éclosion en absence (Control)
ou en présence de Nodal
(50ng/mL). Clichés obtenus par
microscopie à épifluorescence.
Pour chaque condition, à G
lumière transmise, à D
fluorescence. Le jour 1 correspond à l'éclosion du blastocyste, équivalent au jour 4,5 (pc). On remarquera que la différence d'intensité de la fluorescence est présente dès le jour 2 et que la fluorescence persiste plus longtemps en présence de Nodal. On notera également la présence de petites vésicules au contenu sombre dès le jour 3 en absence de Nodal.
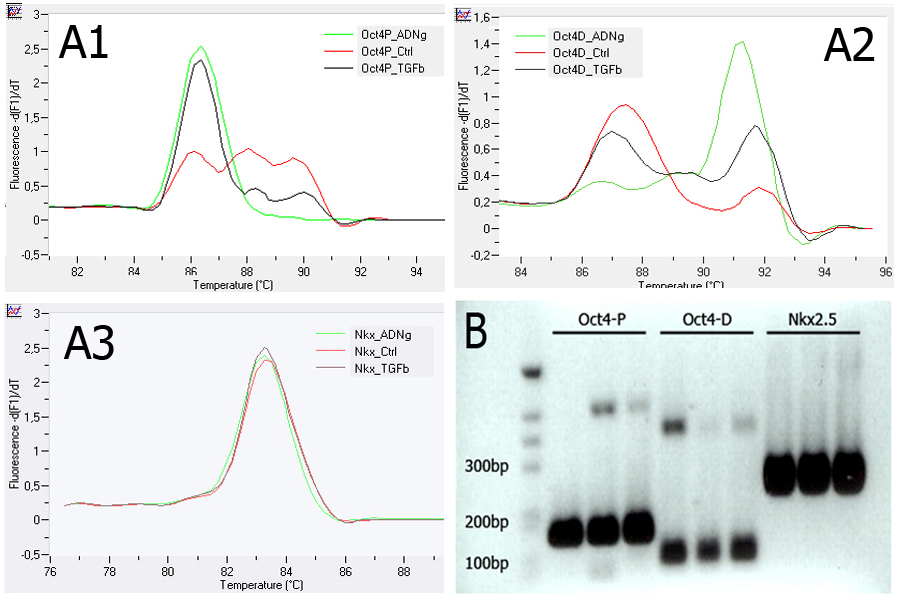

Fig. 4 : TGF-β induit l'expression de Oct-4 par
l'intermédiaire de Smad4. A. Courbes de
fusion pour les différents fragments amplifiés
par RT-qPCR. A1 : promoteur proximal de Oct-4
(Oct-4 P), A2 : promoteur distal de Oct-4 (Oct-4 D),
A3 : promoteur de Nkx2.5. Le promoteur de Nkx2.5
constitue un contrôle positif. En vert : ADN
génomique. En rouge : fragments d'ADN obtenus
par ChIP à partir de cellules non traitées. En noir :
fragments d'ADN obtenus par ChIP à partir de
cellules traitées par TGF-β. B. Analyse sur gel
des différents fragments amplifiés par RT-
qPCR. Les tailles attendues des fragments sont :
187 bp pour Oct-4 P, 148 bp pour Oct-4 D, 255 bp
pour Nkx2.5.
L'analyse quantitative montre que le nombre de
L'upregulation d'Oct-4 in vitro induit la
fragments amplifiés dans les promoteurs
différenciation cardiaque.
proximal et distal de Oct-4 est plus important
lorsque les cellules sont traitées par TGF-β : ceci
Afin de préciser le rôle de l'upregulation de Oct-
montre donc que TGF-β induit effectivement
4 observable in vivo, des cellules ES issues du
l'induction de Oct-4 par l'intermédiaire de
clone ZHBTc6 ont été mises en culture pendant
Smad4, ce dernier se fixant directement sur le
48h en l'absence de tétracycline. Le taux
promoteur de Oct-4. Le contrôle positif permet
d'expression de Oct-4 et de différents marqueurs
de vérifier que l'immuno-précipitation s'est
embryonnaires est évalué par RT-qPCR [Fig. 5].
réalisée avec la même efficacité pour les deux
conditions. L'analyse qualitative sur gel permet de s'assurer de la présence des fragments attendus : pour Oct-4 P, on obtient une bande proche de 200 bp ; pour Oct-4 D, on obtient une bande entre 100 et 200 bp ; pour Nkx2.5, on obtient une bande entre 200 et 300 bp. Cette première série d'expérience a permis de conforter le rôle de Nodal dans l'induction de Oct-4, vraisemblablement par l'intermédiaire de Smad4, à la fois in vitro et in vivo et suggère
fortement son implication dans le pic
d'expression transitoire observable dans les
Fig. 5 : L'upregulati
on de Oct-4 in vitro induit l'expression
de gènes cardiaques. Résultats d'analyse d'expression par
blastocystes âgés de 4,5 à 8,5 jours (pc). Afin de
RT-qPCR. En rouge : ma
rqueurs mésodermiques (points :
déterminer plus précisément le rôle de ce pic
mésoderme cardiaque ; barres : cœur). En Orange : marqueurs
mésendodermiques. En Vert : marqueurs endodermiques. En
d'expression au cours du développement
s ectodermiques. Le taux d'expression des
embryonnaire, deux séries d'expériences ont été
différents gènes est normalisé par rapport au taux d'expression
entreprises : des expériences d'
de la tubuline. Le niveau relatif d'expression est calculé en
upregulation de
prenant comme référence
le taux d'expression en présence de
Oct-4 in vitro en utilisant le clone tet-OFF
tet. Les bâtons représenten
t les moyennes, les barres d'erreur
représentent les écarts-type. Moyennes et écarts-type ont été
ZHBTc6, reconnu pour son efficacité dans
calculés sur six expériences.
l'induction de Oct-4 [Niwa et al. 2000] et des
expériences de downregulation d'Oct-4 in vivo
On remarque tout d'abord que le pourcentage
par l'utilisation des ARN interférents.
d'induction de Oct-4 est proche de celui obtenu
par traitement par Nodal (cf Fig. 2). On
différenciées, que les gènes du mésoderme
remarque ensuite que les gènes significativement
cardiaque, ainsi que les gènes proprement
induits correspondent aux gènes du mésoderme
cardiaques sont fortement induits. On remarque
cardiaque (Tbx6, Mesp1) et aux gènes
également que Brachyury, marqueur du
proprement cardiaques (Nkx2.5, Tbx5, Mef2c,
mésoderme primitif, est très fortement induit
Myocardin, Actin). Les forts taux d'induction
(×35) : ceci s'explique vraisemblablement par le
suggèrent l'existence d'une voie de signalisation
fait que le fort taux de Oct-4 a induit la
directe entre Oct-4 et ces mêmes gènes.
prolifération des cellules précurseurs du
Parallèlement, les marqueurs des autres feuillets
mésoderme. Ces données permettent donc de
embryonnaires sont peu affectés par
conclure que la spécification cardiaque, observée
l'upregulation de Oct-4 (α-FP, TPA, Nestin).
chez les cellules ES non différenciées, aboutit
Ces données tendent à montrer que
effectivement à la différenciation cardiaque.
l'upregulation de Oct-4 induit la spécification
des cellules vers le mésoderme cardiaque.
La downregulation de Oct-4 in vivo aboutit à un
Afin de s'assurer que cette spécification
développement embryonnaire anormal.
cardiaque aboutit effectivement à une
différenciation cardiaque, ces cellules ont subi le
Une autre voie d'investigation pour préciser le
même traitement que précédemment puis ont été
rôle du pic d'expression transitoire de Oct-4
mises en différenciation par la méthode des
consiste à empêcher l'apparition de ce pic et à en
gouttes en absence de tetracycline
étudier les conséquences sur le développement
pendant 2
jours. Les corps embryoïdes ainsi formés ont
embryonnaire. La stratégie utilisée est celle des
ensuite été mis en suspension en absence de
ARN interférents : des blastocystes âgés de 4,5
jours (pc) ont été collectés et injectés avec un
pendant 3 jours. Le taux
d'expression d'Oct-4 et de différents marqueurs
siRNA anti-Oct-4 associé au peptide vecteur
embryonnaires est évalué par RT-qPCR [
MPG2. Ceux-ci sont ensuite réimplantés dans
l'utérus de souris pseudo-gestantes. Les
embryons âgés de 12,5 jours (pc) sont extraits de
l'utérus des souris et leur morphologie est
analysée afin de détecter d'éventuelles anomalies
développementales [Fig. 7].
n de Oct-4 in vitro induit la
différenciation cardiaque. Résultats d'analyse d'expression
par RT-qPCR. En rouge
: marqueurs mésodermiques (points :
mésoderme cardiaque ; barre
s : cœur). En Orange : marqueurs
mésendodermiques. En Bleu : marqueurs ectodermiques. Le
taux d'expression des différent
s gènes est normalisé par rapport
au taux d'expr
ession de la tubuline. Le niveau relatif
d'expression est calculé en prenant comme référence le taux d'expression en présence de
tet. Certains gènes n'ont pas été
: Tal1, SRF, aFP, TPA. Les mesures n'ont pas été
Dans le cas des corps embryoïdes, les taux
Fig. 7 : La downregulation de Oct-4 provoque un
d'induction sont beaucoup plus importants : Oct-
développement embryonn
aire anormal. A. Résultats
4 est induit 14 fois plus qu'en condition contrôle.
rphologiques des embryons âgés de 12,5
jours (pc). Les résultats sont exprimés en pourcentage.
Ceci est à relier au fait que les cellules ont été
: n=87. Les bâtons
placées en différenciation en l'absence de
t les moyennes, les barres d'erreur
représentent les écarts-type. B. Embryons âgés de 12,5
tetracycline, ainsi le promoteur inductible est
: MPG2 seul, le développement est normal. B2 :
resté activé pendant 5 jours consécutifs. On
MPG2 + siRNA, léger retard de croissance. B3 : MPG2 + siRNA, retard de croissance sévère.
remarque, à l'instar des cellules ES non
On remarque tout d'abord que le MPG2 seul
notre cas, il s'agit de Nkx2.5), une observation
n'affecte pas le développement des embryons,
attendue de part leur rôle cardiogénique au cours
alors que la présence du siRNA entraîne une
de l'embryogenèse [Akhurst et al. 1990]. On
forte proportion d'embryons avortés (60 à 75%).
notera également la présence de bandes vers
La plupart des embryons ayant survécu jusqu'au
: celles-ci semblent dépendre de la
jour 12,5 (pc) accusent un retard de croissance
séquence du primer
; elles résultent
notable. Ces observations semblent donc
vraisemblablement de la fixation non spécifique
souligner l'importance de l'existence du pic
des primers du fait de la faible pureté des
d'expression transitoire de Oct-4. Il serait ici
échantillons à la suite de l'immuno-précipitation
intéressant de déterminer avec plus de précision
de la chromatine.
quels tissus sont affectés par l'interférence à
Afin de tester plus directement le rôle
d'Oct-4 dans cette spécification cardiaque des
cellules ES, nous avons utilisé un clone
Les expériences d'upregulation et de
inductible contenant une cassette tet-OFF dans le
downregulation d'Oct-4 permettent d'éclaircir
promoteur d'Oct-4. Ces expériences ont
quelque peu la fonction biologique du pic
confirmé que l'élévation du niveau d'expression
d'expression transitoire d'Oct-4 : celui-ci semble
d'Oct-4, dans la cellules ES, d'une amplitude
indispensable pour la spécification du
similaire à celle induite par les facteurs
mésoderme cardiaque, puis pour la
cardiogéniques de la superfamille du TGFβ,
différenciation cardiaque proprement dite.
déclenche l‘expression de gènes marqueurs du
L'absence ce pic s'avère peu viable pour les
mésoderme et des progéniteurs cardiaques. Cet
évènement se traduit par la suite par un
processus de cardiogenèse accrue dans les corps
embryoïdes. Les expériences d'induction
Discussion
réalisées sur les corps embryoïdes révèlent des
taux d'induction très élevés du fait de
Nous avons révélé que le niveau
l'activation du promoteur d'Oct-4 pendant 5
d'expression de Oct-4 s'élève transitoirement au
jours. Il serait ainsi intéressant de reproduire ces
cours de la différenciation précoce des cellules
manipulations en n'activant le promoteur que
de la couche interne du blastocyste avant de
pendant 48h, afin de mimer le pic d'expression
diminuer progressivement. Ce résultat suggère
transitoire observable in vivo. Ces résultats
que le facteur de transcription Oct-4 a non
auraient une plus grande signification
seulement un rôle de gardien de la pluripotence
de ces cellules mais aussi une fonction dans leur
Nous avons enfin mené des expériences
différenciation précoce. Des expériences in vitro
de downregulation d'Oct-4 in vivo par
et in vivo, ont de plus montré que Nodal, un
l'intermédiaire d'ARN interférents dirigés contre
facteur inducteur du mésendoderme chez les
l'ARN messager d'Oct-4. L'efficacité
Vertébrés et en particulier du mésoderme
d'inhibition d'expression par l'ARN interférent
cardiaque [Conlon et al. 1994, Zhou et al. 1993]
étant difficilement évaluable, nous avons été
stimule l'expression d'Oct-4. Le fait que
contraints de multiplier les échantillons afin de
l'intensité et l'étendue de la fluorescence de la
réaliser une étude statistique. Celle-ci révèle que
GFP, dont l'expression est pilotée par le
les embryons traités par le siRNA n'arrivent pas
promoteur d'Oct-4, soient maximales dans les
à terme ou bien présentent un retard de
cellules du blastocyste en différenciation au jour
croissance et des malformations. Il serait
3 en présence de Nodal peut en effet être corrélé
intéressant de déterminer quels tissus sont
avec l'existence du pic d'expression d'Oct-4 (le
affectés par la downregulation d'Oct-4 par la
jour 3 après éclosion correspondant au jour 6,5
réalisation de coupes histologiques, bien que
(pc)) (cf. Fig. 1).
nous puissions spéculer que la fonction
Nous avons ensuite montré que la
cardiovasculaire, sans doute altérée chez ces
stimulation de l'expression d'Oct-4 par les
embryons, affecte le développement d'autres
facteurs de la superfamille du TGF-β emprunte
la voie de signalisation des Smads. On remarque,
Pour conclure, notre étude a montré
au cours de cette expérience, que ces mêmes
qu'un même facteur peut, dans des conditions
facteurs induisent des gènes cardiaques (dans
particulières (niveau d'expression, cinétique
d'expression.) être impliqué dans des processus
différenciation (milieu précédent sans LIF), sont
biologiques à priori incompatibles
déposées sur le couvercle d'une boîte puis
pluripotence et la différenciation cellulaire. Le
renversées. Les corps embryoïdes sont
cas d'Oct-4 vient ainsi alimenter le concept
observables deux jours plus tard.
également au cours du développement cardiaque
Extraction des ARN et Transcription Inverse
avec Tbx20 [Takeuchi et al. 2005]. Ce concept
développe l'idée qu'un même gène peut
La totalité des ARN cellulaires des cellules ES et
entraîner des effets cellulaires très contrastés en
des corps embryoïdes sont extraits par
fonction de son niveau d'expression. Un tel
l'utilisation d'un Kit d'extraction (Zymo
concept rend donc sujets à caution les résultats
Research, CA, USA). La transcription inverse est
d'inactivation totale de gènes, abondants au
réalisée sur 1 µg d'ARN par l'utilisation de la
cours de la dernière décennie, obtenus par la
transcriptase inverse Mu-MLV (Invitrogen,
technique du Knock-Out. Dans l'optique de
tester ce concept, une approche haut-débit par
l'étude de l'interactome (ChIP on Chips) et du
Real Time – quantitative PCR
transcriptome (RNA Chips) dans différentes
Les réactions d'amplification sont réalisées dans
conditions d'expression d'Oct-4 se révèlerait
un LightCycler® (Roche Diagnostics,
riche d'informations.
Switzerland) selon les recommandations du
constructeur : chaque capillaire contient 10 µL
de Reaction Mix (Taq polymérase, tampon de
Matériel et Méthodes
réaction, désoxynucléotides triphosphate, SYBR
Green I dye®) et 2 µL d'ADNc. Le programme
Lignées de cellules ES
d'amplification comprend
dénaturation (8min / 95°C), la phase
CGR8 : la lignée cellulaire CGR8 a été établie à
d'amplification de 45 cycles (3s / 95°C, 10s /
partie de la masse interne d'un blastocyste de
65°C, 10s / 72°C). Après amplification, une
souris âgé de 3,5 jours. La différenciation
courbe de fusion pour chaque échantillon est
spontanée des cellules CGR8 est inhibée par la
obtenue par une augmentation lente et linéaire de
présence de LIF. Leur culture ne nécessite pas de
la température de 0,1°C à 95°C : cette courbe est
utilisée pour évaluer la spécificité des produits
de PCR, confirmée par la suite par une analyse
ZHBTc6 : la lignée cellulaire ZHBTc6 a été
obtenue par l'introduction d'une construction tet-
OFF dans des cellules ES de souris. Les cellules
Immuno-précipitation de chromatine (ChIP)
ZHBTc6 ont un allèle d'Oct-4 inactivé par
l'intégration d'une cassette IRESzeopA
Les cellules subissent tout d'abord une étape de
contenant un transgène Oct-4 dont le promoteur
cross-linking dans une solution de
est régulé par la tétracycline. Ce transgène est
PBS/formaldéhyde 1%. Elles sont ensuite
activé en l'absence de tétracycline. Leur culture
perméabilisées puis lysées dans un tampon de
ne nécessité pas de « feeders ».
lyse SDS 1%. Afin d'améliorer cette étape, les
cellules sont soniquées 10 fois par 6 pulses de 3s
Propagation, induction et différenciation des
et d'amplitude 70. Le lysat est épuré par une
cellules ES
incubation de 4h à 4°C en présence de billes de
protéine A – Sepharose®. Une petite quantité
Les cellules ES sont propagées sur des boîtes
(50 à 100 µg) de la chromatine ainsi purifiée est
gélatinisées en présence de GMEM supplémenté
mise en présence de l'anticorps pendant 12h à
avec du pyruvate, des acides aminés non
4°C. La fraction de chromatine immuno-
essentiels, du mercaptoéthanol, du sérum fétal de
précipitée est récupérée après une incubation de
veau et du LIF. Les expériences d'induction sont
4h à 4°C en présence de billes de protéine A –
réalisées sur 48h en présence de 10 ou 50 ng/mL
Sepharose® puis subit une étape de reverse
de Nodal ou 2,5 ng/mL de TGF-β. Les cellules
cross-linking dans une solution de NaCl 5M.
ES sont mises en différenciation par la méthode
L'ADN est ensuite extrait par un traitement au
des gouttes : des gouttes de 25 µL, contenant
phénol-chloroforme.
entre 1000 et 1500 cellules/mL dans du milieu de
Interférence à ARN
Yeo C, Whitman M. Nodal signals to Smads through cripto-
dependent and cripto-independent mechanisms. Mol. Cell,
2001 (7, 949–957)
Le siRNA anti-Oct-4 a été obtenu par synthèse
chimique et purifié par HPLC. Après hybridation
Zhou X, Sasaki H, Lowe L, Hogan BL, Kuehn MR. Nodal is
des brins sens et anti-sens, le siRNA est associé
a novel TGF-beta-like gene expressed in the mouse node
au peptide vecteur MPG2. Les blastocystes,
during gastrulation. Nature, 2000 (361:543–47)
collectés à partir de souris gestantes, sont
microinjectés avec le MPG2 seul ou lié au
siRNA. Les blastocystes ainsi microinjectés sont
réimplantés dans des souris pseudo-gestantes.
Je tiens à assurer Michel Pucéat, Franck
Aimond, Claudine Ménard et Corinne Grey de
Séquences des oligonucléotides utilisés
toute ma gratitude pour leurs conseils avisés et
Oct-4 F : 5'-TCAGCTTGGGCTAGAGAAGG-3'
leur disponibilité.
Oct-4 R : 5'-TGACGGGAACAGAGGGAAAG-3'
Oct-4-P F : 5'-CAGGGCATGGTGTAGGAGCAGA-3'
Oct-4-P R : 5'-AAGGAGACGGGATTAGGAGGAG-3'
Oct-4-D F : 5'-CCAAAAGAGAAATCACAATCCA-3'
Oct-4-D R : 5'-GGCTACAACCTCCCCACACC-3'
GMEM : Glasgow Minimum Essential Medium
Oct-4-siRNA F : 5'-AGGUGUUCAGCCAGACCACdtdt-3'
HPLC : High Pressure Liquid Chromatography
Oct-4-siRNA R : 5'-GUGGUCUGGCUGAACACCUdtdt-3'
LIF : Leukemia Inhibitory Factor pc : post-coitum
RT-qPCR : Real Time – quantitative PCR
SCF : Stem Cell Factor
Références bibliographiques
tet : tétracycline
TGF : Transforming Growth Factor
Akhurst RJ, Lehnert SA, Faissner A, Duffie E. TGF beta in
murine morphogenetic processes: the early embryo and
cardiogenesis. Development, 1990 (108, 645-656).
Conlon FL, Lyons KM, Takaesu N, Barth KS, Kispert A, et
al. A primary requirement for nodal in the formation and
maintenance of the primitive streak in the mouse.
Development, 1994 (120, 1919–1928).
Kumar A, Novoselov V, Celeste AJ, Wolfman NM, ten Dijke
P, Kuehn MR. Nodal signaling uses activin and
transforming growth factor-beta receptor-regulated Smads.
J. Biol. Chem., 2001 (276, 656–661).
Lee MA, Heasman J, Whitman M. Timing of endogenous
activin-like signals and regional specification of the
Xenopus embryo. Development, 2001 (128, 2939–2952).
Nichols, J., Zevnik, B., Anastassiadis, K., Niwa, H., Klewe-
Nebenius, D., Chambers, I. and Smith, A. Formation of
pluripotent stem cells in the mammalian embryo depends
on the POU transcription factor Oct4. Cell, 1998 (95, 379-
391).
Niwa, H., Miyazaki, J. and Smith, A.G. Quantitative
expression of Oct-3/4 defines differentiation,
dedifferentiation or self-renewal of ES cells. Nat Genet,
2000 (24, 372-376).
Takeuchi JK, Mileikovskaia M, Koshiba-Takeuchi K, Heidt
AB, Mori AD, Arruda EP, Gertsenstein M, Georges R,
Davidson L, Mo R, Hui CC, Henkelman RM, Nemer M,
Black BL, Nagy A and Bruneau BG. Tbx20 dose-
dependently regulates transcription factor networks
required for mouse heart and motoneuron development.
Development, 2005 (132, 2463-2474).
Source: http://enslyon.free.fr/rapports/biologie/Mathieu_Gineste_1.pdf
Doctors or Managers – Who has the solutions for workplace wellbeing? IOSH : Wellbeing – That Works! 23 September 2015 Dr Adrian Massey MRCP FFOM Doctors or Managers? Doctors or Managers? Doctors or Managers? Doctors or Managers? The temptation to medicalize life The dangers of medicalizing life Why it is becoming harder to hold the line
Chirurgie de la main 23 (2004) 167–177 L'antibioprophylaxie en chirurgie de la main : à la recherche d'un consensus Antibioprophylaxy in hand surgery: toward a professional consensus C. Dumontier a,*,b, J.-P. Lemerle c a Service de chirurgie orthopédique, hôpital Saint-Antoine, collège de médecine des hôpitaux de Paris, 184, rue du Faubourg-Saint-Antoine, 75571 Paris cedex 12, France








