Sioch.cl
VOL 1 NUMERO 2. AGOSTO 2008
Trabajos de Investigación
Caracterización de Perfiles Proteicos y Peptídicos en
Characterization of Protein and Peptide Profiles in Chronic
Dr. Jorge Gamonal A.
Periodontitis.
Hernández M, Obregón F, Pozo P, Barriga A,
Valenzuela MA.
53
Prof. Dr. Javier Botero. Univ. del Valle, Colombia.
Prof. Dr. Adolfo Contreras. Univ. del Valle, Colombia.
Recuento de Células Infiltrantes CD4+, CD8+ y CD19+ en el
Tejido Gingival de Individuos con Periodontitis Crónica.
Prof. Dr. Raúl De la Sotta Thenoux. Univ. de Chile, Chile.
Recount of CD4+, CD8+ and CD19+ Infiltrate Cells in Gingival
Tissues of Subjects with Chronic Periodontitis.
Prof. Dr. Néstor López Villarroel. Univ. de Chile, Chile.
Cisterna C, Rivera O, Dutzan N.
57
Prof. Dr. Hugo Romanelli. Univ. de Maimónides,
Perfiles Antimicrobianos de Bacterias Subgingivales en
Prof. Dr. Mariano Sanz. Univ. Complutense de Madrid, España.
Pacientes con Periodontitis en Colombia.
Antimicrobial Profiles of Subgingival Bacteria from Periodontititis
Prof. Dr. Juan José Villavicencio Blanco. Univ. Mayor, Chile.
Patients in Colombia.
Prof. Dr. Juan Carlos Carvajal. Univ. de Chile, Chile.
Jaramillo Echeverri A, Betancourth Quiroz M, Mayorga-Fayad I, Castillo Perdomo DM, Aya Castañeda MR, Lafaurie Villamil GI,
Prof. Dr. Darío Migues. USAL - AOA, Argentina.
Botero Torres JE, Contreras Rengifo A.
61
Prof. Dr. Fernando Romo Omazabal. Univ. de Chile, Chile.
Prof. Dr. Ronald Motzfeld Espinosa. Univ. de Chile, Chile.
Prof. Dra. María Angélica Torres. Univ. de Chile, Chile.
Fibromatosis Gingival Hereditaria en Niños. Caso
Prof. Dr. Marcial Sierra Fuentes. Univ. Mayor, Chile.
Hereditary Gingival Fibromatosis in Children. Case Report.
Prof. Dr. Jorge Marín Herrera. Univ. de Chile, Chile.
Taj-Taj P, Dolmestch C
.…….….
66
Prof. Dr. Eduardo de Moraes, UNIFESO Teresópolis, Río de
Janeiro, Brasil.
Prof. Dr. Samy Alamo Alamo, Univ. de Chile, Chile.
Prof. Dr. Enrique Torres Ojeda, Univ. de Chile, Chile.
The TH17 vs. TREG Imbalance in the Pathogenesis of
Prof. Dr. Enrique Kogan, Asociación Dental de México, México.
Periodontitis: New Approach for Dichotomy TH1 vs. TH2.
Dezerega A, Maggiolo S, Garrido M, Dutzan N.
70
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008.
La Revista Clínica de Periodoncia, Implantología y Rehabilitación Oral
(PIRO) publicará artículos de tipo científico o práctico sobre periodoncia,
osteointegración, rehabilitación y especialidades directamente relaciona-
das con ellas. Órgano oficial de difusión científica de la Sociedad de Pe-
riodoncia de Chile, Sociedad de Implantología Oral de Chile y Sociedad
de Prótesis y Rehabilitación Oral de Chile.
Derechos Reservados, Prohibida su Reproducción sin mencionar la fuente.
Representante legal: Dr. Jorge Gamonal A.
Publicación cuatrimestral: Abril - Agosto - Diciem-
bre.
Tiraje: 1500 ejemplares, distribución nacional e internacional. Impresa en Santiago, Chile, en
el mes de Agosto 2008, por Sociedad Impresora y Editora DIPRINT LTDA.
PIRO: Av. Santa María 1990. Providencia, Santiago, Chile. Fono (56 - 2) 335 7692.
Fax (56 - 2) 334 8233.
[email protected] Diseño: Alejandra Pozo G.
[email protected].
Periodista: Patricio Villablanca M.
[email protected]
Trabajo de Investigación
Caracterización de Perfiles Proteicos y Peptídicos en
Characterization of Protein and Peptide Profiles in Chronic Periodontitis
Hernández M1,3, Obregón F1, Pozo P1, Barriga A2, Valenzuela MA2.
La destrucción de los tejidos de soporte durante la periodontitis crónica está mediada por proteasas específicas. Producto de la actividad proteolítica
se generarán cambios en la composición peptídica y proteica globales del fluido crevicular gingival (FCG). El objetivo de este estudio es evaluar la
existencia de patrones de proteicos y peptídicos característicos en el FCG de pacientes con periodontitis crónica y sanos.
Materiales y métodos: Se seleccionaron 8 pacientes con periodontitis crónica moderada a severa y 5 sujetos controles y se obtuvieron muestras de
FCG. Las muestras se eluyeron en 2 tampones, y se prepararon en 3 matrices distintas, y se obtuvieron los espectros peptídicos y proteicos mediante
espectrometría de masas MALDI-TOF. Se procesaron 3 espectros de cada grupo para la obtención final de espectros diferenciales en enfermos.
Resultados: Se obtuvieron patrones proteicos y peptídicos reproducibles en el FCG. En pacientes con periodontitis crónica encontramos perfiles
característicos representados por más de 100 proteínas que no fueron detectables en sujetos sanos.
Conclusiones: Demostramos la utilidad de la aplicación de la espectrometría de masas MALDI-TOF en el análisis de cambios cualitativos en la com-
posición global del FCG y presentamos los perfiles proteicos y peptídicos característicos del FCG en periodontitis crónica y sujetos sanos.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 53-56, 2008.
Palabras claves: Periodontitis crónica, FCG, MALDI-TOF, perfiles proteicos.
Inflammatory response mediates periodontal tissue destruction occurring in chronic periodontitis. As result, qualitative changes in global peptide and
protein GCF composition will generate.
Aim: To evaluate existence of characteristic peptide and protein profiles in gingival crevicular fluid (GCF) from patients with chronic periodontitis and
Methods: Patients with moderate to severe chronic periodontitis (n=8) and healthy controls (n=5) were selected and samples of GCF were obtained.
Samples were eluted in 2 different buffers and prepared with 3 matrices to obtain peptide and protein spectra by MALDI-TOF mass spectrometry
analysis. Subsequently, 3 spectra from each group were processed to obtain final differential spectra.
Results: Reproducible peptide and protein profiles were obtained from both stages in GCF. In disease samples we found characteristic patterns rep-
resented by more than 100 proteins which were undetectable in controls.
Conclusions: We demonstrate for the first time the usefulness of MALDI-TOF mass spectrometry in the analysis of qualitative global changes in GCF
composition and we present protein and peptide characteristic GCF profiles associated with chronic periodontitis and healthy periodontium.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 53-56, 2008.
Key words: Chronic periodontitis, GCF, MALDI-TOF, protein profiles.
del fluido queda modulada por la extensión del exudado plasmático,
fundamentalmente albúmina y otras proteínas de mayor peso molecular.
La periodontitis crónica es una enfermedad infecciosa ca-
Durante la periodontitis, también aparecerán componentes no derivados
racterizada por la destrucción de los tejidos de inserción dentarios, es
del plasma, como mediadores y productos de la destrucción de matriz
decir, el ligamento periodontal, el hueso alveolar y cemento radicular(1).
extracelular periodontal, principalmente colágenos I y III(3).
La inflamación gingival conl eva la formación de un exudado, el fluido
Entre los mediadores de destrucción periodontal se encuen-
crevicular gingival (GCF), cuya composición es similar a la del suero,
tran proteasas específicas, que inducen la degradación de la matriz
aunque varía en función del proceso inflamatorio(2).
extracelular y la activación de otras enzimas en el tejido periodontal.
El FCG presenta componentes derivados del plasma (albúmi-
Entre las principales enzimas involucradas, figuran las serina protea-
na, cadenas pesadas de IgG, transferrina), tejido conectivo, células
sas y las metaloproteinasas de matriz extracelular (MMPs)(4,5,6). Su
hospederas del periodonto y placa subgingval. La formación del FCG
actividad proteolítica no se limita simplemente al catabolismo de pro-
en sitios libres de inflamación y de placa subgingival está mediada por
teínas: regulan el destino y actividad de muchas otras proteínas me-
la difusión pasiva del líquido extracelular de los tejidos periodontales,
diante el control de su localización intra o extracelular, liberándolas de
a través de la lámina basal y las células de los epitelios sulcular y de
la superficie celular, activando o inactivando proteasas u otras enzi-
unión. En condiciones inflamatorias en cambio, aumenta la permeabi-
mas, citoquinas, hormonas y factores de crecimiento, mediante la con-
lidad vascular y epitelial, de modo que la concentración de proteínas
versión de receptores agonistas en antagonistas y la exposición de
1. Laboratorio de Biología Periodontal, Departamento de Odontología Conservadora, Facultad de Odontología, Universidad de Chile. Chile.
2. Depto. de Bioquímica y Biología Molecular, Facultad de Ciencias Químicas y Farmacéuticas, Universidad de Chile. Chile.
3. Departamento de Patología, Facultad de Odontología, Universidad de Chile. Chile.
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008
Hernández M y cols.
proteínas crípticas(5,7,8,10).
Espectrometría de masas
En síntesis, los cambios en la composición del FCG están
mediados por la extravasación de proteínas desde el plasma, la sín-
Las muestras se prepararon en tres matrices: ácido a-ciano-
tesis y procesamiento de mediadores inflamatorios y productos de de-
4-hidroxicinámico (CHCA) a una concentración de 10 mg/mL en ace-
gradación del tejido(11). En estudios previos en geles SDS-PAGE se tonitrilo/ácido fórmico 0,1% v/v 1:1 para el análisis de péptidos de masa
han determinado patrones regulares de composición del FGC entre los molecular menor a 10 kDa; ácido sinapínico (SA) para péptidos y pro-
pacientes sanos y diferencias marcadas en la composición proteica del teínas de masa molecular mayor a 10 kDa y una tercera matriz, ácido
FCG de éstos, en relación con enfermos, observándose variaciones en 2,5-dihidroxibenzoico (DHB) para análisis de péptidos y/o glicopépep-
la proporción de proteínas séricas como albúmina y transferrina.
tidos, proteínas y/o glicoproteínas, polímeros y carbohidratos. Las ma-
La identificación de predictores de progresión representa trices SA y DHB se prepararon a una concentración de 10 mg/mL en
una meta fundamental en periodoncia, debido a que resulta difícil pre-
acetonitrilo/ácido fórmico 0,1% v/v 1:2.
decir la evolución de las lesiones periodontales sobre los parámetros
Para la obtención de los espectros, se mezcló 1 μL de cada
clínicos. Se han propuesto numerosos mediadores bioquímicos como muestra con 9μL de cada matriz (dilución 1:10) y se depositó 1 μL en
indicadores de progresión de la enfermedad periodontal en el fluido una placa porta muestra micro scout. Los espectros se obtuvieron en
crevicular gingival (FCG)(2), como fosfatasa alcalina, MMP-8, Dipep-
un equipo Microflex MALDI-TOF (Bruker Daltonics, Inc. MA-USA). Pre-
tidil peptidasas II y IV, elastasa, calprotectina(12) y MMP-13(13,14); sin vio a la obtención de espectros se realizó una calibración del equipo
embargo, ninguno de ellos constituye en sí un indicador confiable que con un estándar externo para cada intervalo de m/z examinado. Para la
permita predecir nuevos episodios de pérdida de inserción(12).
obtención de los espectros se trabajó en modo ion positivo y detección
El análisis global de la composición del FCG permitirá ca-
en reflexión para el intervalo de m/z 0-4000 y en modo ion positivo y
racterizar las alteraciones del sistema en la enfermedad. De este modo, detección lineal para los intervalos de m/z de 5000-20000 y 10000-
el examen de la composición global del FCG y sus variaciones durante 250000 (se usaron los parámetros por defecto). Los espectros finales
los estados de salud y enfermedad periodontal permitirán identificar corresponden a espectros sumados correspondientes a 10 barridos de
perfiles proteicos y peptídicos característicos, reflejo de los procesos láser aplicados en diferentes puntos tomados al azar.
metabólicos asociados con la destrucción del tejido óseo y ligamento
Los espectros obtenidos fueron procesados (eliminación
periodontal y a través del análisis de éstos, la identificación de marca-
de línea base) y exportados utilizando el programa flexAnalysis v2.2
dores y/o predictores de progresión en sitios específicos(3,15).
(Bruker Daltonik GmbH, Germany). Se generaron espectros promedio
El objetivo de este estudio es evaluar la existencia de pa-
para las muestras y controles utilizando el programa SpecAlign v2.2.1
trones de proteicos y peptídicos característicos en el FCG de pacientes (University of Oxford, England). A partir de éstos, mediante el mismo
con periodontitis crónica y sanos.
programa se generaron los espectros diferenciales y los listados m/z. Fi-
nalmente, la visualización de los espectros diferenciales y sus respecti-
vas señales m/z se realizó mediante el programa mMass v2.4 (Institute
of Chemical Technology, Rep Checa).
El análisis estadístico de las características clínicas de los
Selección de pacientes
sujetos y controles se realizó empleando el programa Intercooled Stata
V8.1 (Stata Corp. Texas, USA), y se aplicó el test de Mann Whitney. Se
Los pacientes se seleccionaron en el Servicio de Recepción consideró significancia estadística cuando p<0,05.
de Pacientes de la Facultad de Odontología, Universidad de Chile y
del SSMN, CDT Eloísa Díaz. Se incluyeron sujetos con periodontitis
crónica moderada a severa según los siguientes criterios: presencia
RESULTADOS
de un mínimo de 14 dientes, excluyendo los terceros molares, de los
cuales al menos 6 eran dientes posteriores; de severidad moderada
Se analizaron los espectros peptídicos y proteicos de FCG
a avanzada: al menos 5-6 dientes con bolsas periodontales ≥5 mm, provenientes de 13 sujetos, de los cuales 8 presentaban periodonti-
pérdida de inserción ≥3 mm y pérdida de hueso determinada en una tis crónica severa a moderada y 5 correspondientes a controles. Las
radiografía; no haber recibido nunca tratamiento periodontal; sin en-
características clínicas de los sujetos se presentan en la tabla 1; no se
fermedad sistémica que pueda afectar la patología de la periodontitis encontraron diferencias significativas entre ambos grupos con respecto
y/o que requiera premedicación médica; sin medicación de antibióticos a edad y género, mientras que todos los parámetros clínicos variaron
o de antiinflamatorios en los últimos 3 meses. Los sujetos del grupo significativamente entre ambos grupos.
control corresponden a voluntarios sin enfermedad periodontal. El pro-
Las muestras de FCG se eluyeron en dos tampones, co-
tocolo del estudio previamente evaluado y aprobado por el Comité de rrespondientes a Tris-HCl 50 mM pH 7,5, NaCl 0,2 M, CaCl2 5 mM y
Ética de la Facultad de Odontología, se explicó a todos los pacientes, Tritón X-100 al 0,01% y en ácido fórmico 0,02%, para establecer cuál
quienes firmaron el consentimiento informado.
de ellos era más apropiado para realizar el análisis por MALDI-TOF.
Los espectros obtenidos a partir de muestras eluidas en tampón Tris
demostraron una mayor sensibilidad y menor ruido que aquellas elui-
Recolección de Fluido Crevicular Gingival (FCG)
das en ácido fórmico (datos no mostrados).
Para evaluar qué tipo de matriz es era más apropiada para la
Las muestras de FCG se obtuvieron a partir de sacos pe-
obtención de espectros correspondientes a los distintos rangos de ma-
riodontales de 8 pacientes con periodontitis crónica y 5 controles. Las sas de péptidos y proteínas detectables en el FCG, según sensibilidad
piezas seleccionadas se aislaron con rollos de algodón, previa remo-
y resolución de éstos, las muestras se prepararon con tres matrices dis-
ción de la placa bacteriana supragingival. El sitio fue secado cuida-
tintas. La matriz CHCA demostró mayor sensibilidad para péptidos en-
dosamente con una jeringa de aire y el fluido se recolectó con tiras de tre 2-4 kDa (Figura 1), mientras que para los péptidos de masa mayor,
papel Periopaper® (ProFlow, Amityvil e, New York) introducidas dentro el ácido sinapínico (Figuras 2 y 3).
de un tubo eppendorf estéril y se almacenaron a -80ºC hasta su elu-
El espectro correspondiente al intervalo de péptidos menores
a 2000 Da no se pudo analizar debido a la presencia de un polímero no
identificado (resultados no mostrados).
Al analizar los espectros obtenidos entre sujetos con peri-
Análisis del fluido gingival crevicular
odontitis y entre sujetos sanos, observamos patrones proteicos y pep-
tídicos repetidos y por tanto reproducibles, para todos los rangos de
Después de recolectado el fluido, 3 muestras correspon-
peso molecular analizados (4-250 kDa). Al comparar los espectros en-
dientes a enfermos y 3 a sanos se extrajeron desde las tiras de papel tre sujetos enfermos y sanos se observaron notables variaciones en
en un tubo eppendorff con 100 μL de amortiguador de elución Tris-HCl los perfiles peptídicos y proteicos y por tanto, cambios en la compos-
50 mM pH 7,5, NaCl 0,2 M, CaCl2 5 mM, Tritón X-100 al 0,01%, mien-
ición del FCG correspondiente a cada grupo. El grupo con periodontitis,
tras que otras 7 muestras (5 enfermos y 2 controles) se extrajeron en muestra un aumento de las proteínas y péptidos que componen el FCG
ácido fórmico al 0,02% y centrifugación a 10.000 g por 5 min a 4ºC. Las en relación con los controles, fundamentalmente entre 2500 y 75000
muestras se mantuvieron a -80° hasta su posterior utilización.
Da (Figuras 1, 2 y 3).
Mediante la obtención de los espectros promedio correspon-
Caracterización de Perfiles Proteicos y Peptídicos en Periodontitis Crónica
dientes a cada grupo, se obtuvieron espectros diferenciales y a partir de
éstos, los listados m/z, que representan el conjunto de proteínas y pép-
tidos detectables en todas las muestras enfermas y a la vez, ausentes
en todos los controles estudiados (Tabla 2).
Tabla 1. Parámetros clínicos de los sitos estudiados de pacientes con periodontitis
crónica y controles.
Controles (n = 5)
Periodontitis (n = 8)
Profundidad de saco (mm)
Nivel de inserción (mm)
Figura 1. Espectro de péptidos del FCG entre 2-4 kDa (matriz CHCA).
% sitios con placa
% sitios con sangramiento
*Valores expresados como promedios±DS. *p<0.05
Tabla 2. Espectro diferencial Intervalo de masas 5-20 kDa y 10-250 kDa (Matriz
# m/z intensity # m/z intensity # m/z intensity
132.07 47 9789.69
Figura 2.
Espectro de péptidos y proteínas del FCG entre 2-20 kDa (matriz SA).
5 12704.80 1226.00 4 5140.46
72.67 49 9952.87
6 13279.40 1483.67 5 5160.80
75.41 50 10189.20 105.14
7 13300.40 1486.66 6 5225.22
66.16 51 10402.30
8 13441.90 1311.66 7 5315.96
106.28 52 10450.50 199.29
9 15141.80 17296.70 8 5420.86
10 15341.40 5911.34
53 10586.20 233.67
11 15895.80 7159.33 9 5630.46
141.05 54 10845.00 2223.34
12 16051.40 4183.00 10 5725.75
108.67 55 10956.50
13 30276.20 518.00 11 5773.69
140.09 56 11055.60 300.05
14 31044.00 650.33 12 5864.61
95.17 57 11252.10
15 31204.70 588.00 13 5941.67
191.57 58 11453.40 117.21
16 32062.30 329.67 14 6074.04
54.66 59 11553.20
17 66429.30 304.00 15 6105.80
18 66433.10 327.00
54.00 16 6131.95
95.44 61 12698.90 475.25
21.67 17 6350.11
134.18 62 12781.70
95.09 63 12900.30
79.62 64 13165.00
66.79 65 13274.50 183.00
82.61 66 13349.90
Figura 3. Espectro de proteínas del FCG entre 20-250 kDa (matriz SA).
22 6650.68 1776.99 67 13466.00
100.68 68 14973.40 151.44
209.26 69 15057.20 107.85
203.80 70 15132.00 6099.74
197.28 71 15239.60
Las enfermedades periodontales son un grupo de patologías
59.92 72 15341.20 1002.63
multifactoriales que involucran destrucción de los tejidos duros y blan-
87.01 73 15506.30
dos periodontales, como resultado principalmente de la activación de
109.78 74 15550.70
58.66 75 15708.80
la respuesta inmunoinflamatoria del hospedero frente a la infección
31 7572.57 1916.87 76 15794.60
bacteriana, que incluye la producción de citoquinas, eicosanoides
408.95 77 15873.20 2334.33
y MMPs(16). La destrucción de los tejidos de soporte es el hecho ca-
669.87 78 15987.90 122.80
racterístico de la periodontitis crónica y ocurre durante la progresión de
68.44 79 16079.90 286.93
la enfermedad(17).
53.25 80 16168.50 138.67
Hasta la fecha se han analizado más de 100 componentes
69.25 81 16407.80
del FCG y su potencial utilidad en la detección de la periodontitis(12);
sin embargo, considerando que los sistemas de proteasas trabajan en
forma sinérgica y son altamente redundantes(5), el análisis de los cam-
bios globales en la composición del FCG podría ser de mayor utilidad
en la caracterización de los distintos estados de salud-enfermedad del
Nuestros resultados demuestran la existencia de patrones
proteicos y peptídicos característicos en el FCG de pacientes con pe-
riodontitis crónica que difieren sustancialmente de los patrones obteni-
dos en sujetos sanos.
Estudios previos han descrito cambios en la composición del
FCG entre individuos sanos y con periodontitis crónica. Mediante elec-
troforesis en geles SDS-PAGE se ha determinado la existencia de pa-
trones regulares en la composición del FCG en sujetos sanos y enfer-
mos, demostrando diferencias marcadas entre ambos; principalmente
con respecto a la proporción de proteínas séricas como albúmina y
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008
Hernández M y cols.
transferrina, que aumentan considerablemente en enfermos. En mo-
dores de destrucción tisular local o de origen bacteriano(10,18), entre los
delos de periodontitis inducida por ligaduras en perros, el análisis del cuales se han identificado defensinas HNP-1, -2 y -3(19,20) y calprotecti-
FCG mediante electroforesis bidimensional ha demostrado aumentos nas-A y –B(2).
de proteínas con masas inferiores a 64 kDa en comparación con gingi-
El estudio de la periodontitis crónica a través del análisis del
vitis, fenómeno que podría atribuirse al aumento de la actividad prote-
FCG representa un método no invasivo(19); sin embargo, un inconve-
olítica en el crévice gingival(3).
niente en la caracterización de este fluido está representada por los es-
Además de los cambios cualitativos, en estudios recientes casos volúmenes posibles de obtener a partir del surco gingival o saco
hemos observado aumentos considerables en la concentración de pro-
periodontal, limitando el análisis a la detección de un sólo analito(20).
teínas totales de pacientes con periodontitis v/s sanos y en sitios ac-
Por esta razón, la utilización de la espectrometría de masas MALDI-
tivos v/s inactivos de pacientes con periodontitis progresiva(14).
TOF en este estudio, ha demostrado ser un método útil y relativamente
En conformidad con estos antecedentes, mediante análisis sensible para el análisis de los cambios en la composición global del
de espectrometría de masas MALDI-TOF, en el presente estudio he-
FCG. Sin embargo, se requieren estudios posteriores que conduzcan a
mos detectado patrones reproducibles en la composición del FCG de la identificación de las proteínas de interés, mediante análisis de elec-
sujetos enfermos y controles. Adicionalmente, observamos cambios ca-
troforesis bidimensional, determinación de masas por huellas peptídi-
racterísticos en la composición del FCG de los sujetos con periodontitis cas y secuenciación MS/MS, para comprender en mayor profundidad la
crónica en comparación con los sanos, representados por la detección patogenia de la enfermedad y proponer nuevos marcadores de destruc-
de más de 100 proteínas que no se encuentran en los controles. De este ción periodontal.
modo, la identificación de estas variaciones en el FCG podría representar
Como conclusión, en este trabajo se demuestra por primera
una herramienta de utilidad en el diagnóstico de los estados de salud y vez la utilidad de la aplicación de la espectrometría de masas MALDI-
enfermedad periodontal producto de la periodontitis crónica.
TOF en el análisis de cambios cualitativos en la composición global del
El rango donde se observó la mayor variabilidad entre ambos FCG y presentamos los perfiles proteicos y peptídicos característicos
grupos, se encontró entre los 2500 y 75000 Da, lo que concuerda con del FCG en periodontitis crónica y sujetos sanos.
estudios previos, donde el área de mayor PM correspondería funda-
mentalmente a proteínas extravasadas desde el suero, como albúmina,
transferrina y α-1 antitripsina(2).
Por otro lado, las proteínas de menor peso molecular y pép-
tidos, podrían reflejar en parte la actividad proteolítica de los tejidos
periodontales, caracterizada por la degradación de matriz extracelular Este trabajo fue financiado por el Proyecto DI MULT 06/05-2.
y la activación de otras enzimas(5).
Consecuentemente, se ha propuesto que estas proteínas y
péptidos podrían corresponder fundamentalmente a productos y media-
1. Bor el LN, Papapanou PN. Analytical epidemiology of periodontitis. J Clin Periodontol
roles of MMPs in cancer. Cancer Metastasis Rev 2006;25:69-75.
10. Newby AC. Matrix metalloproteinases regulate migration, proliferation, and death of vas-
2. Kojima T, Andersen E, Sanchez JC, Wilkins MR, Hochstrasser DF, Pralong WF, Cimasoni
cular smooth muscle cel s by degrading matrix and non-matrix substrates. Cardiovascular
G. Human gingival crevicular fluid contains MRP8 (S100A8) and MRP14 (A100A9), two
calcium binding proteins of the S100 family. J Dent Res 2000;79(4.):740-747.
11. Overall C, McCulloch C. Proteolytic host cell enzymes in gingival crevice fluid. Peri-
3. Curtis MA, Sterne J, Price SJ, Griffiths GS, Coulthurst SK, Wilton JM, Johnson NW. The
protein composition of gingival crevicular fluid sampled from male adolescents with no de-
12. Loos BG, Tjoa S. Host-derived diagnostic markers for periodontitis: do they exist in
structive periodontitis: Baseline data of a longitudinal study. J Periodont Res 1990;25:6-16.
gingival crevice fluid? Periodontol 2000. 2005;39:53-72.
4. Ingman T, Tervahartiala T, Ding Y, Tsesche H, Haerian A, Kinane DF, Konttinen YT, Sorsa
13. Hernández M, Valenzuela MA, Lopez-Otin C, Alvarez J, Lopez JM, Vernal R, Gamonal
T. Matrix metalloproteinases and their inhibitors in gingival crevicular fluid and saliva of peri-
J. Matrix metalloproteinase-13 is highly expressed in destructive periodontal disease activ-
odontitis patients. J Clin Periodontol 1996;23:1127-1132.
ity. J Periodontol. 2006 Nov;77(2.):1863-70.
5. López-Otín C, Overal C. Protease degradomics: a new chal enge for proteomics. Nat
14. Hernández M, Martínez B, Tejerina JM, Valenzuela MA, Gamonal J. MMP-13 and
Rev Mol Cel Biol 2002; 3: 509-519.
TIMP-1 determinations in progressive chronic periodontitis. J Clin Periodontol. 2007
6. Puente X, Sánchez L, Overall C, López-Otín C. Human and Mouse proteases: a com-
Sep;34(11.):729-35.
parative genomic approach. Nat Rev Genet 2003;4:544-556.
15. Adonogianaki E, Mooney J, Kinane DF. Detection of stable and active periodonti-
7. Pardo A, Selman M. Matrix metalloproteinases in aberrant fibrotic tissue remodeling. Proc
tis sites by clinical assesment and gingival accute.phase protein levels. J Periodont Res
Am Thorac Soc 2006;3:383-388.
8. VanSaun MN, Matrisian LM. Matrix metalloproteinases and cellular motility in develop-
16. Salvi GE, Lang NP. Host response modulation in the management of periodontal dis-
ment and disease. Birth Defects Res (part C) 2006;78:69-79.
eases. J Clin Periodontol 2005; 32: 108-129.
9. Overal CM, Dean RA. Degradomics: Systems biology of the protease web. Pleiotropic
17. Vernal R, Chapar o A, Graumann R, Puente J, Valenzuela MA, Gamonal J. Levels of
cytokine receptor activator of nuclear factor κB ligand in gingival crevicular fluid in untreated
chronic periodontitis patients. J Periodontol 2004, 75:1586-1591.
18. Mäkelä M, Söderling E, Paunio K, Talonpoika J, Hyyppä T. Protein composition of crev-
Marcela Hernández Ríos
icular fluid before and after treatment. Scand J Dent Res. 1991 Oct;99(7.):413-23.
19. Lundy FT, Orr DF, Shaw C, Lamey PJ, Linden GJ. Detection of individual human neu-
trophil alpha-defensins (human neutrophil peptides 1, 2 and 3) in unfractionated gingival
crevicular fluid -a MALDI-MS approach. Mol Immunol. 2005 Mar;42(7.):575-9.
Trabajo recibido el 31/03/2008.
20. Pisano E, Cabras T, Montaldo C, Piras V, Inzitari R, Olmi C, Castagnola M, Messana
Aprobado para su publicación el 13/05/2008.
I. Peptides of human gingival crevicular fluid determined by HPLC-ESI-MS. Eur J Oral Sci.
Trabajo de Investigación
Recuento de Células Infiltrantes CD4+, CD8+ y CD19+ en el
Tejido Gingival de Individuos con Periodontitis Crónica
Recount of CD4+, CD8+ and CD19+ Infiltrate Cells in Gingival Tissues of Subjects
with Chronic Periodontitis
Cisterna C1, Rivera O1, Dutzan N1.
La periodontitis es una enfermedad inflamatoria del tejido periodontal, iniciada por el biofilm subgingival, que genera la destrucción progresiva de las
estructuras de inserción dentaria. La naturaleza de la respuesta inflamatoria, determinaría el carácter destructivo de la enfermedad, considerándose
un importante modelo para investigar el potencial patológico del infiltrado celular. En la periodontitis, este infiltrado incluye linfocitos T y B. Los linfoci-
tos T CD4+ y T CD8+, efectores de la inmunidad celular, son claves en la inmunorregulación, pues pueden generar una respuesta celular o humoral.
La relación T CD4+/CD8+ es considerada un indicador de la función del sistema inmune. Para determinar los porcentajes de células CD4+, CD8+
y CD19+ en el tejido gingival de individuos con periodontitis crónica y periodonto sano, y el valor de la razón entre las células CD4+/CD8+, toma-
mos biopsias de tejido gingival a 17 sujetos con periodontitis crónica y 11 periodontalmente sanos. Las muestras fueron digeridas en colagenasa,
inmunotipificadas y analizadas mediante citometría de flujo, obteniendo que los porcentajes de todas las poblaciones estudiadas, así como, el valor
de la razón CD4+/CD8+ aumentaron en las muestras de tejido enfermo respecto al tejido sano. Todas estas diferencias fueron estadísticamente
significativas. Concluimos que las células CD4+, CD8+ y CD19+, son las más abundantes dentro del infiltrado celular de la periodontitis crónica, y
suponemos que las células CD4+ serían claves en la regulación de la respuesta inmune de la enfermedad, dado que su población registró el mayor
aumento en el tejido enfermo.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 57-60, 2008.
Palabras claves: Periodontitis crónica, linfocitos, infiltrado celular.
The periodontitis is an inflammatory disease of the periodontal tissues, initiated by subgingival biofilm, that result in the progressive destruction of
the structures that support the teeth. The nature of inflammatory response, could determine the destructive character of disease, and provides an
important model for investigation of the pathological potential of cellular infiltrates. In the periodontitis, the infiltrates includes lymphocytes T and B.
The lymphocytes T CD4+ and T CD8+, effectors of cellular immunity, are key cells in immunoregulation because they can lead to cellular or humoral
response. The ratio of CD4+/CD8+ is considered to be an important indicator for immune system functions. For determinate the percentages of CD4+,
CD8+ and CD19+ cells in the gingival tissues of periodontal and healthy subjects, and evaluate the CD4+/CD8+ cells ratio, were obtained biopsies of
gingival tissues from 17 chronic periodontitis patients and 11 periodontally healthy subjects. The samples were incubated in collagenase, inmunola-
beling and analyzed using flow cytometry. The obtained percentages in every studied cell population, as well, the ratio CD4+/CD8+ were increased in
the periodontitis biopsies respect to healthy tissues. Every difference was statistically significant. We conclude that CD4+, CD8+ and CD19+, are the
most abundant cells in the chronic periodontitis cellular infiltrate, and we suspect that CD4+ cells could be key on the immune response regulation to
the disease, since this population recorded the higher increase in sick tissues.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 57-60, 2008.
Key words: Chronic periodontitis, lymphocytes, cellular infiltrates.
La periodontitis crónica es una enfermedad de etiología bac-
las que contribuyen a la destrucción que caracteriza a la periodontitis(5-6).
teriana y de naturaleza inflamatoria que afecta a los tejidos de inserción Asimismo, la razón entre las células TCD4+ y las células TCD8+ (CD4+/
del diente, generando la destrucción del ligamento periodontal, cemento CD8+) es considerado un importante indicador del carácter de la re-
radicular y hueso alveolar(1-2).
spuesta inmune, puesto que cada subpoblación celular puede guiar
Los mecanismos de defensa del hospedero frente a la infec-
hacia una respuesta particular, pudiendo ser esta predominantemente
ción pueden ser locales o sistémicos, específicos o inespecíficos, y hu-
celular o predominantemente humoral(7-8). Estudios han determinado los
morales o celulares(3).
niveles sanguíneos de células T y B en individuos con periodontitis(9).
En periodontitis, y específicamente en el infiltrado celular de la No obstante, son pocos los estudios que registran localmente, en los
lesión periodontal establecida y avanzada, los linfocitos del tipo T (LT) y tejidos afectados, la representación que alcanzan estas células(8). Más
B (LB), jugarían un rol clave, dadas sus funciones inmunorreguladoras y aún, los trabajos existentes emplean en su mayoría para el conteo celular
efectoras del sistema inmune(3-4). No obstante, se ha observado también técnicas semicuantitativas(9). Tampoco se han encontrado estudios que
que estas células están involucradas en la patogénesis de la enferme-
simultáneamente cuantifiquen las poblaciones de linfocitos T y B.
dad exacerbando la respuesta inflamatoria frente al biofilm subgingival y
El determinar diferencias en la distribución porcentual de estas
favoreciendo la destrucción tisular(3), principalmente mediante la síntesis células, entre individuos periodontalmente sanos y otros enfermos, po-
de citoquinas como el factor de necrosis tumoral α (TNF-α), interleuquina dría relacionarse con la fisiopatología de la periodontitis crónica(9).
(IL)-6 y el ligando del receptor activador del factor nuclear ĸB (RANKL),
El propósito de este estudio es determinar y comparar el por-
1. Laboratorio de Biología Periodontal, Facultad de Odontología, Universidad de Chile. Chile.
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008
Cisterna C y cols.
centaje de células CD4+, CD8+ y CD19+, así como el valor de la razón medio RPMI 1640 suplementado con 50 µg/mL de Penicilina, 50µg/mL de
CD4+/CD8+ en el tejido gingival de individuos con periodontitis crónica e Estreptomicina y 100 µl/ml de suero bovino fetal al 10%. Luego se realizó
individuos periodontalmente sanos.
un conteo celular en cámara de Neubahuer (EM, Hirschmann Techcolor)
mediante microscopio de contraste de fases (Axiovert 100, Zeiss Co., Ger-
many) donde se evaluó la viabilidad fisiológica celular por exclusión del
MATERIALES Y MÉTODOS
colorante azul de tripán.
Las células obtenidas, fueron divididas en cinco tubos, con
Selección de individuos
200.000 células por tubo, suspendidas en 100 µl de muestra cada uno,
Los sujetos incluidos en este estudio solicitaron tratamiento peri-
tras lo cual se agregó a cada tubo 3 µl del anticuerpo conjugado o isotipo
odontal, en el Centro de Diagnóstico y Tratamiento Dra. Eloisa Díaz, co-
correspondiente, y durante 30 minutos se les mantuvo en un ambiente
rrespondiente al Servicio de Salud Metropolitano Norte, Santiago.
protegido de la luz y a 4°C. Para este proceso se utilizaron los anticuer-
Para conformar el grupo de individuos con periodontitis crónica, pos: anti-CD4 humano de ratón conjugado con isotiocinato de fluoresceí-
se examinaron 56 sujetos, de los cuales 17 cumplieron con los criterios na (FITC) para identificar los linfocitos T cooperadores (CD4+), anti-CD8
de inclusión, he ingresaron al estudio. Dichos criterios fueron: edad ≥35 humano de ratón conjugado con ficoeritrina (PE) para inmunotipificar a
años, 14 o más dientes presentes sin contabilizar los terceros molares, los linfocitos T citotóxicos (CD8+), y anti-CD19 humano de ratón conju-
de los cuales al menos 6 debían ser molares. Presentar al menos 4 sa-
gado con FITC para identificar la población de linfocitos B (CD19+) (BD
cos periodontales con PS ≥ 5 mm, 6 sitios periodontales con NIC ≥3 mm Pharmingen™). Como controles de la emisión de fluorescencia se usaron
y evidencia radiográfica de reabsorción ósea. Los criterios de exclusión los isotipos FITC y PE.
comprendieron: terapia periodontal previa, condiciones médicas que ame-
Posteriormente, las muestras fueron analizadas en un citómetro
ritaran premedicación antibiótica, ingesta de antibióticos, anti-inflamatorios de flujo FACSort Becton Dickinson (Becton Dickinson Immunocytometry
esteroidales o no esteroidales y/o hormonas 6 meses antes del comienzo System, San Jose, Ca, USA).
del estudio, embarazo, fumar 10 o más cigarrillos diarios, o enfermedades
que afecten el desarrollo de la enfermedad periodontal.
Como grupo control se estudió a 11 individuos, de edad ≥35
Análisis de datos
años, con al menos 14 dientes sin contabilizar los terceros molares, y de
Los datos obtenidos por citometría de flujo fueron graficados en
periodonto sano. Los criterios de exclusión para este grupo fueron los mis-
software WinMDI® versión 2.8 y analizados en software estadístico Graph
mos que se utilizaron para el grupo de individuos con periodontitis.
Pad Instat®, versión 3.06 (graph Pad software, Inc. Ca, USA).
Previo al inicio del estudio, todos los participantes firmaron un
Para el análisis de las variables de PS, NIC y la edad de los
consentimiento informado, aprobado por el comité de ética de la Facultad sujetos, se empleó la prueba estadística Welch's corrected t-test. Las va-
de Odontología de la Universidad de Chile. Los sujetos enfermos ingre-
riables dicotómicas sangramiento al sondaje y presencia de placa al igual
saron a un programa de tratamiento y mantención de enfermedades pe-
que el género se analizaron utilizando la prueba estadística Fisher's test.
En tanto, los porcentajes de células CD4+, CD8+, y CD19+, así como el
valor de la razón CD4+/CD8+ del grupo estudio y del grupo control, se
les comparó individualmente aplicando la prueba estadística Welch's co-
En todos los individuos, un investigador calibrado efectuó medi-
ciones dicotómicas respecto a la presencia de placa, tras lo cual realizó
una profilaxis supragingival, para facilitar el uso de los instrumentos de
medición. Luego se tomaron mediciones replicadas de profundidad al
RESULTADOS
sondaje (PS) y nivel de inserción clínica (NIC), y una medición dicotómica
respecto del sangramiento al sondaje, todo en seis sitios por diente (me-
siobucal, bucal, distobucal, distolingual, lingual, mesiolingual).
El grupo de individuos con periodontitis crónica, quedó constituido
Para estas mediciones se utilizó una sonda periodontal milime-
por un 64,71% de mujeres y un 35,29% de hombres (11 mujeres y 6 hom-
trada, tipo Carolina del Norte (Hu Friedy, Gracey, USA).
bres), de un rango etario entre los 35 y los 73 años (promedio = 51,93 ± 11,53
A los individuos con periodontitis crónica se les tomó una bi-
años). En el grupo control, el 54,54% fueron mujeres y el 45,45% hombres
opsia de tejido gingival, seleccionándose un sitio periodontal con una PS (6 mujeres y 5 hombres) cuyas edades fluctuaron entre los 35 y los 59 años
≥ 5mm y una pérdida de inserción clínica ≥ 3mm. En tanto, las biopsias (promedio = 45,3 ± 9,01 años). No existieron diferencias significativas entre
de individuos periodontalmente sanos, provinieron de sitios sometidos a los grupos experimental y control para estas variables (p>0,05).
cirugía periodontal por motivos de alargamiento coronario de indicación
El promedio de PS y NIC de los individuos con periodontitis
respecto de los individuos periodontalmente sanos fue de 4,24 ± 0,77 mm
versus 1,45 ± 0,19 mm (p<0,0001) y de 5,14 ± 1,33 mm versus 1,55
± 0,25 mm (p<0,0001) respectivamente. Mientras que, el porcentaje pro-
Recuento de células mediante citometría de flujo
medio de sitios con sangramiento al sondaje y con presencia de placa
Inmediatamente después de su obtención, las biopsias fueron bacteriana fueron de 62,25% ± 10,41 y 54,78 % ± 6,7 en individuos con
sumergidas en 5 ml de medio de transporte RPMI 1640 suplementado periodontitis y de 16,4% ± 3,42 (p<0,0001) y 13,57 % ± 8,85 (p=0,0378)
con 50 µg/mL de Penicilina, 50 μg/mL de Estreptomicina y 0,1% de L-
en individuos con periodonto sano.
Glutamina(10), manteniéndolas a 4°C hasta ser procesadas. Al momento
de su procesamiento, las muestras fueron lavadas en amortiguador PBS
Recuento celular
estéril, eliminando detritus y restos de sangre. Luego, fueron pesadas en
Tal como se puede observar en la tabla 1, el porcentaje de célu-
una balanza analítica (AFA 120 LC, ADAM®) y seccionados, empleando las CD4+, CD8+ y CD19+, fue mayor en las muestras de individuos con
un bisturí de hoja número 15. Después se incubaron en un medio de periodontitis que en las de individuos periodontalmente sanos. Todas estas
digestión compuesto por: RPMI 1640, 0,1% L-glutamina, 290 ui/mL de diferencias porcentuales en el número de las células estudiadas, fueron
colagenasa clostridial tipo IV, 50 μg/mL de penicilina, 50 μg/mL de estrep-
tomicina, en una relación de 1 mL de solución de digestión por cada 50 mg
de tejido(10), durante 12 horas ("overnight") en baño termorregulado (mod.
LC3 0155, DAIHAN LAB TECH Co., LTDA. Korea) a 37°C, y agitación
constante. Posteriormente las muestras fueron tamizadas utilizando un
cel strainer de nylon (BD FalconTM, Ma USA) y lavadas tres veces en
PBS estéril mediante centrifugación (Gosheimerser 56. Hermle Labortech-
nik GMBH®, Germany) a 2.500 r.p.m., durante 10 minutos y a 4°C, y se
resuspendieron en 500 µl de medio de cultivo completo, compuesto por





Recuento de Células Infiltrantes CD4+, CD8+ y CD19+ en el Tejido Gingival de Individuos con Periodontitis Crónica
Tabla 1. Porcentaje de células CD4+, CD8+ y CD19+, y valor de la razón CD4+/CD8+,
en el tejido gingival de individuos con periodontitis e individuos sanos. (Promedio ± des-
viación estándar).
Periodontitis Sanos
n = 17 n = 11
Células CD4+ (%) 31,37 ± 15,28 5,29 ± 2,05 €
Células CD8+ (%) 15,4 ± 4,71 3,67 ± 1,58 ¥
Células CD19+ (%) 34,35 ± 16,01 10,87 ± 4,38¢
Razón CD4+/CD8+ 2,03 ± 0,65 1,44 ± 0,93 Ħ
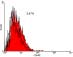
Figura 3. Density Plot e histogramas de una muestra representativa para la determinación
€ Porcentaje de células CD4+ en sujetos con periodontitis v/s sanos, p value < 0,0001.
del porcentaje de células CD19+ a) Density plot, que relaciona tamaño (eje ordenadas)
¥ Porcentaje de células CD8+ en sujetos con periodontitis v/s sanos, p value < 0,0001.
v/s complejidad (eje abscisas) de los eventos registrados por el citómetro de flujo. El área
¢ Porcentaje de células CD19+ en sujetos con periodontitis v/s sanos, p value = 0,005.
delimitada abarca las células presentes en la muestra y que luego fueron graficadas; b)
Ħ Razón de células CD4+/CD8+ en sujetos con periodontitis v/s sanos, p value = 0,018.
y c) histogramas del número de células (eje de ordenadas) v/s la intensidad de fluores-
cencia de estas (eje de abscisas). En blanco se observa el control y en verde la muestra
Recuento de células CD4+
inmunotipificada con anti hCD19-FITC. Se indica el porcentaje promedio de células posi-
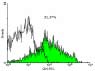
En la figura 1 podemos observar, que el porcentaje de células tivas para el marcaje. b) Individuos con periodontitis crónica; c) individuos sanos.
CD4+ en las muestras de individuos con periodontitis fue de 31,37% ±
15,28 respecto del total de células analizadas, mientras en el grupo con-
Recuento de células CD19+
trol el valor fue de 5,29% ± 2,05 (p<0,0001). Comparativamente, fue en
Como muestra la figura 3, en el tejido gingival del grupo de es-
esta población celular donde se constató la mayor diferencia porcentual tudio, el porcentaje promedio de células CD19+ llegó al 34,35% ± 16,1
entre el tejido sano y enfermo (tabla 1).
versus el 10,87% ± 4,38 del grupo control (p = 0,005).
Relación células CD4+/CD8+
El valor de la razón CD4/CD8, tuvo un promedio mayor en el
grupo de estudio que en el grupo control (tabla 1). El valor promedio para
la razón correspondió en los individuos con periodontitis a 2,03 ± 0,65, y
en los individuos periodontalmente sanos a 1,44 ± 0,93 (p = 0,018).
Figura 1. Density Plot e histogramas de una muestra representativa para la determi-
nación del porcentaje de células CD4+ a) Density plot que relaciona tamaño (eje ordena-
Los resultados en lo relativo a los porcentajes de células CD4+,
das) v/s complejidad (eje abscisas) de los eventos registrados por el citómetro de flujo. El CD8+ y CD19+, no guardaron correlación con respecto a las caracterís-
área delimitada abarca las células presentes en la muestra y que luego fueron graficadas; ticas clínicas de los individuos incluidos en este estudio.
b) y c) histogramas del número de células (eje de ordenadas) v/s la intensidad de fluores-
cencia de estas (eje de abscisas). En blanco se observa el control y en verde la muestra
inmunotipificada con anti hCD4-FITC. Se indica el porcentaje promedio de células positi-
vas para el marcaje. b) Individuos con periodontitis crónica; c) individuos sanos.
La predominancia de los linfocitos en el infiltrado celular del
tejido afectado por periodontitis, de manifiesto en este trabajo, avala la
idea que este segmento del infiltrado celular es responsable de la regu-
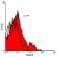
Recuento de células CD8+
lación de la respuesta inmune en los tejidos periodontales(11). Además,
Tal como se aprecia en la figura 2, en el tejido gingival del los cambios en la composición del infiltrado celular, entre el tejido sano
grupo de individuos enfermos el porcentaje de células CD8+ ascendió al y enfermo, dan señales de una alteración local en los eventos inmunor-
15,4% ± 4,71 del total de células de la muestra, mientras que en individ-
regulatorios del huésped(12).
uos sanos las células CD8+ representaron el 3,67% ± 1,58 (p < 0,0001).
En cuanto a los valores que obtuvimos para las células CD4+
Recuento de células CD19+.
y CD8+, estos se asemejan a los disponibles en la literatura. En biopsias
Como muestra la figura 3, en el tejido gingival del grupo de es-
de tejido gingival los trabajos existentes muestran que la cantidad de
tudio, el porcentaje promedio de células CD19+ llegó al 34,35% ± 16,1 células CD4+ y CD8+ aumentan en el tejido enfermo respecto al tejido
versus el 10,87% ± 4,38 del grupo control (p = 0,005).
sano(13-14). Entre los estudios que utilizan citometría de flujo para analizar
biopsias de tejido enfermo, se puede establecer un rango para las células
CD4+ que fluctúa entre el 21,63 % ± 8,17 (7) y el 30,7 % ± 3,9 (15) del total
de células. Mientras que para las células CD8+ este rango va desde el
8,58% ± 3,92(8) al 14,6% ± 1,6(15).
En cuanto a la cantidad de células CD19+, fenotipo expresado
por los LB, Cobb et al 1989(16) mediante inmunohistoquímica determinó
que estos incrementan su número 20 veces en el tejido enfermo respecto
al sano. Este tipo celular en conjunto con su forma celular diferenciada,
Figura 2. Density Plot e histogramas de una muestra representativa para la determi-
la célula plasmática, constituyen según otros estudios, el tipo celular pre-
nación del porcentaje de células CD8+ a) Density plot que relaciona tamaño (eje ordena-
dominante del infiltrado celular en periodontitis crónica(17-20). No obstante,
das) v/s complejidad (eje abscisas) de los eventos registrados por el citómetro de flujo. El el hecho que los LB se encuentren en mayor proporción que los LT en
área delimitada abarca las células presentes en la muestra y que luego fueron graficadas; periodontitis, no es consistente en todos los estudios, existiendo reportes
b) y c) histogramas del número de células (eje de ordenadas) v/s la intensidad de fluo-
que señalan un predominio de LT por sobre LB(21), o al menos una rel-
rescencia de estas (eje de abscisas). En blanco se observa el control y en rojo la muestra ación de igualdad en sus proporciones(22). Esto último, se asemeja a la
inmunotipificada con anti hCD8-PE. Se indica el porcentaje promedio de células positivas relación entre LT y LB que nosotros encontramos.
para el marcaje. b) Individuos con periodontitis crónica; c) individuos sanos.
En tanto, los estudios que han investigado la razón entre célu-
las CD4+/CD8+ parecen variar dependiendo del método de evaluación
y el lugar de obtención de la muestra(8,23). Orbak et al 2003(7), determinó
mediante citometría de flujo un valor promedio de la razón CD4+/CD8+
en periodontitis crónica de 2,93 ± 1,68. Semejante al valor de Erciyas et
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008
Cisterna C y cols.
al 2006(8), que con un protocolo similar, determinó que el promedio para el sujeto fuese sometido a tratamiento, lo que en nuestra opinión, refleja
esta razón era 2,80 ± 1,26. No obstante, Seymour et al 1997(15), en biop-
con mayor exactitud los procesos inmunológicos desarrollados durante la
sias de tejido gingival y empleando citometría de flujo, determinó un valor patología.
de la razón CD4+/CD8+ igual a 1.0 ± 0,1 en individuos con periodontitis
Es destacable que algunos estudios al evaluar el infiltrado ce-
crónica y de 1,8 ± 0,2 en individuos periodontalmente sanos. Valores que lular en el tejido gingival, antes y después del tratamiento periodontal
además contrastó con análisis en sangre periférica, donde obtuvo 2,1 ± no quirúrgico, determinaron que la densidad de células T y B declina
0,1 para individuos con periodontitis, y 2,1 ± 0,1 para individuos sanos.
después del tratamiento(7-8,24), lo cual se aproxima a lo encontrado en el
Otros trabajos que compararon biopsias de tejido gingival de tejido sano.
sitios activos, inactivos y sanos, observaron que en los sitios activos
existía una mayor proporción de LB que en los sitios estables(24). Asi-
mismo, Liljenberg et al 1994(14), encontró que LT y LB están en mayor CONCLUSIONES
proporción en sitios activos que en sitios inactivos, aunque no registró
diferencias entre sitios enfermos y sitios inactivos.
El presente trabajo demuestra que existe un aumento estadís-
Esta información podría explicar la alta desviación estándar ticamente significativo en la proporción de células CD4+, CD8+ y CD19+
que obtuvimos en el recuento de las células CD4+ y CD19+. Esto porque, en el tejido gingival de individuos con periodontitis crónica, comparado
tomamos biopsias de tejido gingival enfermo, sin conocer si los sitios es-
con el tejido gingival de individuos periodontalmente sanos, al igual que
taban activos o inactivos. A la luz de la información, existiría una diferen-
en el valor de la razón entre células CD4+/CD8+.
cia en el recuento de estas células dependiendo del estado de progresión
Este trabajo enfocado en las células que protagonizan la
de la enfermedad(14,24), por lo que sería de esperar que la cantidad de respuesta inmune adquirida, junto a nuevas investigaciones, en el futuro
linfocitos variara marcadamente entre las muestras de periodontitis, y en puede facilitar el entendimiento acerca de los mecanismos celulares y
consecuencia, registrar una alta desviación estándar en nuestros datos, moleculares involucrados en la periodontitis. Esto a su vez, puede llevar
tal como sucedió.
al desarrollo de nuevas modalidades de diagnóstico y tratamiento de la
Las diferencias existentes entre los resultados obtenidos por enfermedad.
otros investigadores y nuestros hallazgos se deben en parte al tipo de
muestra analizada. En los estudios previos, las muestras estudiadas se
obtuvieron posterior a la fase no quirúrgica del tratamiento periodontal, AGRADECIMIENTOS
lo que produce una disminución en la cantidad y calidad del biofilm sub-
gingival y por tanto una disminución de la inflamación y de la cantidad
Este estudio de investigación fue financiado por el Proyecto
de células infiltrantes en los tejidos afectados. En nuestro trabajo, las Fondecyt 1050518.
muestras de los individuos con periodontitis se recolectaron antes de que
1. Socransky S, Haffajee A. The bacterial etiology of destructive periodontal disease: current 10. Stoufi ED, Taubman MA, Ebersole JL, Smith DJ. Preparation and characterization of
concepts. J periodontol. 1992; 63(4): 322-331.
human gingival cells. J Periodontal Res. 1987; 22(2): 144-149.
2. Socransky S, Haffajee A, Cugini M, Smith C, Kent Jr. Microbial complexes in subgingival 11. Han X, Kawai T, Eastcot J, Taubman M. Bacterial-responsive B lymphocytes induce
plaque. J Clin Periodontol. 1998; 25: 134-144.
periodontal bone resorption. The journal of immunology. 2006; 176: 625-631.
3. Kornman K, Page R, Tonetti M. The Host response to the microbial challenge in peri-
12. Teng Y. The role of acquired immunity and periodontal disease progression. Crit Rev
odontitis: assembling the players. Periodontol 2000. 1997; 14: 33-53.
Oral Biol Med. 2003; 14(4): 237-252.
4. Page R, Schroeder H. Pathogenesis of inflammatory periodontal disease. A summary of 13. Reinhardt RA, Bolton RW, McDonald T, DuBois LM, Kaldahl WB. In situ lymphocyte sub-
cur ent work. Lab Invest. 1976; 34(3): 235-249.
populations from active versus stable periodontal sites. J Periodontol. 1988; 59: 656–670.
5. Vernal R, Dutzan N, Hernández M y cols. High expression levels of receptor activator 14. Liljenberg B, Lindhe J, Berglundh T, Dahlen G, Jonsson R. Some microbiological, his-
of nuclear factor-kappa B ligand associated with human chronic periodontitis are mainly topathological and inmunohistochemical characteristics of progressive periodontal disease.
secreted by CD4+ T lymphocytes. J Periodontol. 2006; 77: 1772-1780.
J Clin Periodontol. 1994; 21: 720-727.
6. Takayanagi H. Inflammatory bone destruction and osteoimmunology. J Periodontal Res. 15. Seymour G, Taubman M, Eastcot J, Gemmel E, Smith D. CD29 expression on CD4+
2005; 40: 287-293.
gingival lymphocytes supports migration of activated memory T lymphocytes to diseased
7. Orbak R, Erciyas K, Erzurum H. Flow cytometric analysis of T-lymphocyte subsets after periodontal tissue. Oral Microbiol inmunol. 1997; 12 (3): 129-134.
different treatment methods in smokers and non smokers with chronic periodontitis. Int Dent 16. Cobb CM, Singla O, Feil P, Theisen, F, Schultz R. Comparison of NK-cel (Leu-7+ and
J. 2003; 53: 159-164.
Leu-11b+) populations in clinically healthy gingiva, chronic gingivitis and chronic adult peri-
8. Erciyas K, Orbak R, Kavrut F, Demir T, Kaya I . The changes in T lymphocyte subsets odontitis. J Periodontal Res. 1989; 24(1):1-7.
following periodontal treatment in patients with chronic periodontitis. J Periodont Res. 2006; 17. Seymour G, Greenspan J. The phenotypic characterization of lymphocyte subpopula-
41: 165–170.
tions in established human periodontal disease. J Periodontal Res. 1979; 14: 39-46.
9. Malberg K, Molle A, Streuer D, Gangler P. Determination of lymphocyte populations and 18. Lindhe J, Liljenberg B, Listgarten M. Some microbiological and histopathological fea-
subpopulations extracted from chronically inflamed human periodontal tissues. J Clin Peri-
tures of periodontal disease in man. J Periodontol. 1980; 51(5): 264-269.
odontol. 1992; 19: 155-158.
19. Okada H., Kida T, Yamagami H. Identification and distribution of immunocompetent
cel s in inflamed gingiva of human chronic periodontitis. Infection and Immunity. 1983; 41:
20. Passo S, Reinhardt RA, DuBois LM, Cohen D. Histological characteristics associated
with suppurating periodontal pockets. J Periodontol. 1988; 59(11): 731-740.
21. Modeer T, Dahllof G, Axio E, Sundqvist K. Subpopulations of lymphocytes in connective
Nicolás Dutzan Muñoz
tissue from adolescents with periodontal disease. Acta Odontologica Scandinavia. 1990;
Olivos 943. Independencia. Santiago. Chile.
48: 153–159.
22. Berglundh T, Liljenberg B, Tarkowski A, Lindhe J. Local and systemic TCR V gene ex-
pression in advanced periodontal disease. J Clin Periodontol. 1998; 25: 125-133.
23. Taubman M, Kawai T. Involvement of T-lymphocytes in periodontal disease and in direct
and indirect induction of bone resorption. Crit Rev Oral Biol Med. 2001; 12(2): 125-135.
Trabajo recibido el 27/02/2008.
24. Berglundh T, Donati M. Aspects of adaptative host response in periodontitis. J Clin Peri-
Aprobado para su publicación el 01/07/2008.
odontol. 2005; 32 (6): 87-107.
Trabajo de Investigación
Perfiles Antimicrobianos de Bacterias Subgingivales en
Pacientes con Periodontitis en Colombia
Antimicrobial Profiles of Subgingival Bacteria from Periodontititis
Patients in Colombia
Jaramillo Echeverri A1,2, Betancourth Quiroz M3,2, Mayorga-Fayad I4,5, Castillo Perdomo DM4,5,
Aya Castañeda MR4,5, Lafaurie Villamil GI4,5, Botero Torres JE1,2, Contreras Rengifo A1,2
Introducción: La sensibilidad in vitro a los antimicrobianos de las bacterias asociadas a periodontitis es diferente entre distintas poblaciones. En
América Latina, pocos estudios han descrito la sensibilidad a los antimicrobianos de los periodontopatógenos. Este estudio determinó la sensibilidad
de bacterias periodontopáticas aisladas de pacientes colombianos sanos y con periodontitis, frente a 6 antimicrobianos usados comúnmente como
terapia adjunta para el tratamiento de la enfermedad periodontal.
Materiales y métodos: Se estudiaron aislados de Aggregatibacter actinomycetemcomitans (n=23), Porphyromonas gingivalis (n=74), Prevotella in-
termedia/nigrescens (n=38), Tannerella forsythia (n=8), Enterobacteriaceas (n=89) y bacilos Gram negativos no fermentadores (n=26) cultivados a
partir de muestras subgingivales de 127pacientes colombianos con periodontitis crónica, 68 con periodontitis agresiva y 11 sanos o con gingivitis. Se
realizó la prueba de E- test® para establecer la concentración inhibitoria mínima a tetraciclina, ciprofloxacina, amoxicilina, metronidazol, azitromicina
y clindamicina.
Resultados: Se encontró sensibilidad de los periodontopatógenos a la mayoría de los antimicrobianos. Aunque A. actinomycetemcomitans mostró
resistencia al metronidazol, amoxicilina y clindamicina y P. intermedia/nigrescens fue resistente a varios de los antimicrobianos probados. Las demás
bacterias anaerobias fueron sensibles a la mayoría de ellos. No se observaron diferencias entre los perfiles de sensibilidad de las bacterias en pa-
cientes con enfermedad periodontal y en pacientes sanos. Los bacilos Gram negativos entéricos fueron resistentes a la amoxicilina y sensibles a la
Conclusión: La terapia antimicrobiana adjunta al tratamiento periodontal de pacientes colombianos con periodontitis debe ser administrada cuidadosa-
mente, pues existe una gran variabilidad en la resistencia a los antimicrobianos de las bacterias periodontopatógenas.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 61-65, 2008.
Palabras claves: Periodontitis crónica, periodontitis agresiva, sensibilidad antibiótica, E-test, bacterias periodontopáticas.
Background: In vitro antimicrobial susceptibility of microorganisms associated to periodontitis has showed different results among world populations.
In Latin America, few studies have described antimicrobial susceptibility of periodontopathogens. This study determined antimicrobial susceptibility of
some bacteria isolated from healthy and periodontitis Colombian patients for six commonly used antimicrobials as adjunctive therapy for periodontal
disease treatment.
Methods: Isolates of Aggregatibacter actinomycetemcomitans (n=23), Porphyromonas gingivalis (n=74), Prevotella intermedia/nigrescens (n=38),
Tannerella forsythia (n=8), Enterobacteriaceae (n=89) and non fermenters Gram negative rods (n=26) from subgingival samples of 127 patients with
chronic periodontitis, 68 with aggressive periodontitis and 11 healthy/gingivitis patients were tested by means of the E-test®. The minimal inhibitory
concentration (MIC) of tetracycline, ciprofloxacin, amoxicillin, metronidazole, azythromicin and clindamycin was tested for each isolate.
Results: High antimicrobial susceptibility of periodontopathogens was found to most of tested antimicrobials. However, A. actinomycetemcomitans
showed resistance to metronidazole, amoxicillin and clindamycin and P. intermedia/nigrescens showed resistance to most of tested antimicrobials. No
differences of susceptibilities to antimicrobials were observed between periodontal diagnoses. Gram negative rods were resistant to amoxicillin and
susceptible to ciprofloxacin.
Conclusions: Antimicrobial supportive therapy for the treatment of Colombian patients affected with periodontitis should be carefully administered con-
sidering that there is a great variability of susceptibility to antimicrobial agents among periodontopathic species.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 61-65, 2008.
Key words: Chronic periodontitis, aggressive periodontitis, antimicrobial susceptibility, E-test, periodontopathic bacteria.
dad antimicrobiana(2). La sensibilidad a los antibióticos de los microorga-
nismos asociados a enfermedad periodontal puede variar entre países,
El uso de antimicrobianos sistémicos como coadyuvantes en debido en gran parte a razones socioculturales (alto consumo de anti-
la terapia periodontal es controversial. No existe en la actualidad un con-
bióticos, poca adherencia a una correcta dosificación) lo que ayuda a
senso con respecto a su uso, al tipo de antimicrobiano o a la condición aumentar la resistencia a los antimicrobianos seleccionados usados con-
clínica periodontal a la cual se debe aplicar. En pacientes con periodon-
múnmente en la terapia periodontal(3).
titis agresivas, fumadores o poco respondedores a la terapia mecánica,
Las bacterias asociadas a la etiología de enfermedades perio-
el uso de los antibióticos puede mejorar el pronóstico del tratamiento. Sin dontales comprenden un grupo heterogéneo de microorganismos capnó-
embargo, aun en estos casos es poco claro el tipo de fármaco a usar, las filos y anaerobios estrictos, dentro de los que se cuentan Aggregatibacter
dosis y el tiempo de duración del tratamiento(1).
actinomycetemcomitans, Tannerella forsythia, Treponema denticola, Por-
Dos de los criterios más importantes en la elección del agente phyromonas gingivalis, Prevotella intermedia, Prevotella nigrescens, en-
antimicriobiano para el tratamiento de la enfermedad periodontal son la tre otros(4).
identificación de la microbiota subgingival y la de su perfil de sensibili-
1. Escuela de Odontología, Universidad del Valle, Cali, Colombia.
2. Grupo Medicina Periodontal.
3. Escuela de Bacteriología, Universidad del Valle, Cali, Colombia. 4. Facultad de Odontología, Universidad El Bosque, Bogotá, Colombia.
5. Grupo UIBO, Unidad de Investigación Básica Oral.
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008
Jaramillo Echeverri A y cols
Estas bacterias exhiben diversos comportamientos frente a los después de 48 horas de obtenidas, en dos laboratorios de microbiología
antibióticos disponibles para su tratamiento. En España, en pacientes que usaron técnicas estandarizadas para el procesamiento microbiológico
con periodontitis, se reporta un porcentaje de resistencia de P. intermedia de identificación y pruebas de susceptibilidad.
de 33% a la amoxicilina, 16.7% a la tetraciclina y 11.1% a la clindam-
Se utilizó el agar TSBV, incubado a 36°C por 3 a 5 días en una
icina; siendo estos niveles de resistencia son mucho más elevados que atmósfera de 5% de CO2 para la recuperación de A. actinomycetemcomi-
los observados en Holanda(3). También se ha encontrado resistencia de tans, mientras que el agar sangre Brucella incubado a 36°C por 10 días
aislados de P.gingivalis en pacientes con periodontitis agresiva a anti-
se usó para la recuperación de los organismos anaerobios estrictos que
bióticos como clindamicina (13%) y ciprofloxacina (73%)(5). Estos últimos fueron estudiados. La identificación se hizo de acuerdo a las característi-
resultados no se observaron en otro estudio donde la sensibilidad a la cas morfológicas de las colonias y pruebas bioquímicas adicionales (11), así
clindamicina y ciprofloxacina fué total(6). En España también se describe como el sistema comercial Rapid Ana II®. Para el aislamiento de los bacilos
una resistencia mayor de A. actinomycetemcomitans a la amoxicilina y Gram negativos entéricos se utilizó el agar MacConkey incubado por 24
azitromicina (33.3%), en comparación con Holanda, no obstante en am-
horas a 37°C en aerobiosis y para su identificación se utilizó el sistema
bos países la resistencia a la clindamicina y al metronidazol es similar-
comercial Crystal E/NF®.
mente alta(3).
De otro lado, en el tratamiento de la enfermedad periodontal
se ha observado que el uso de algunos antimicrobianos puede facilitar Pruebas de sensibilidad
la colonización de especies inusuales en el surco y bolsa periodontal.
Existen reportes que indican que después del tratamiento sistémico con
Con el fin de obtener cultivos puros de P. gingivalis, P interme-
eritromicina y doxiciclina, se presenta un aumento en el aislamiento de dia/nigrescens, y Tanerella forsythia las colonias fueron subcultivadas en
bacilos Gram negativos entéricos(7,8). Los bacilos Gram negativos en-
agar sangre Brucella. De igual manera, se obtuvieron subcultivos puros de
téricos son aislados frecuentemente en pacientes con enfermedad peri-
A. actinomycetemcomitans en agar TSBV y de los bacilos Gram negativos
odontal. En pacientes con periodontitis crónica se ha reportado que hasta entéricos en agar MacConkey. El método usado para evaluar la sensibili-
un 14% pueden tener organismos de las familias Enterobacteriaceae y dad fue el E-test®, siguiendo las recomendaciones del fabricante, como se
Pseudomonadaceae y que estos en particular son resistentes a antibióti-
describe brevemente: Se preparon los inóculos por separado de bacterias
cos como los betalactámicos y las tetraciclinas. Sin embargo, también anaerobias y microaerofílicas con el estándar 1.0 de McFarland, y de los
se describe la gran sensibilidad que presentan frente a la ciprofloxacina bacilos entéricos con el estándar 0.5. Luego se sembró 0.1 ml de cada in-
gracias a los ensayos in vitro de sensibilidad(9).
óculo de bacterias anaerobias en agar sangre Brucella utilizando una varil-
Este estudio busca determinar los perfiles de suceptibilidad de la de vidrio estéril, mientras que para los bacilos Gram negativos entéricos
cinco patógenos periodontales y de otros microorganismos inusuales en-
la siembra se realizó con un hisopo estéril en agar Mueller-Hinton. Se dejó
contrados en pacientes colombianos con periodontitis crónica, agresiva y secar el inóculo durante 15 minutos y se colocaron dos tiras de E-test® en
en pacientes sanos, lo cual puede sentar las bases de las diferencias en cada caja. Los siguientes antimicrobianos fueron probados en bacterias
la conducta terapéutica con respecto a otros países.
anaerobias y capnofílicas: Amoxicilina, Tetraciclina, Ciprofloxacina, Metro-
nidazol, Clindamicina y Azitromicina. Para los bacilos Gram negativos tipo
Enterobacteriaceae se probaron Amoxicilina, Tetraciclina, y Ciprofloxacina
MATERIALES Y MÉTODOS
mientras que en los no fermentadores sólo se probaron los dos últimos.
Los resultados de las pruebas de sensibilidad fueron determina-
Población de estudio
dos a las 24 horas para bacterias entéricas y 48 horas para anaerobias,
interpretando el valor de la concentración en µg/ml obtenido de la inter-
Se estudiaron 258 cepas de microorganismos aislados de sur-
sección entre la concentración dada por la tira reactiva y el crecimiento
cos o bolsas periodontales de 127 pacientes con Periodontitis Crónica, bacteriano que forma una elipse. A partir de estos datos, se interpretó la
68 con periodontitis agresiva y 11 pacientes periodontalmente sanos o sensibilidad de los microorganismos de acuerdo a las tablas del CLSI (NC-
con gingivitis. Las muestras fueron tomadas en las diversas clínicas de CLS) o a estudios previos(3,12,13).
periodoncia de las universidades participantes: Universidad del Valle, Uni-
El control de calidad de las tiras E-test® fue realizado con las
versidad El Bosque, Instituto de Ciencias de la Salud CES, Universidad cepas ATCC Bacteroides fragilis 25285, Escherichia coli 25922 y Pseu-
Metropolitana de Barranquil a, Universidad Santo Tomás, Universidad de domonas aeruginosa 27853.
Antioquia, Universidad de Cartagena, Universidad Autónoma de Mani-
La base de datos se realizó en Excel ® y se importó en el paquete
Los diagnósticos periodontales de periodontitis crónica (PC), estadístico SPSS 10.0®. Se realizó análisis univariado para establecer las
periodontitis agresiva (PA) e individuos sanos o con gingivitis, fueron reali-
frecuencias de los organismos en la microbiota subgingival y bivariado
zados por los periodoncistas tratantes, previamente calibrados, siguiendo para realizar las comparaciones por diagnóstico periodontal.
los estándares del último consenso de la Asociación Americana de Pe-
Las concentraciones a las cuales el 50% y el 90% de las cepas
riodoncia sobre Clasificación(10). El taller de calibración en los criterios diag-
fueron susceptibles a los antibióticos se definieron como concentración
nósticos comprendió el examen clínico de 15 pacientes en los que se midi-
inhibitoria mínima (CIM) 50 y 90. Los resultados de acuerdo al diagnóstico
eron los parámetros clínicos, se revisaron las historias clínicas, exámenes se compararon mediante la prueba de Wilcoxon.
de laboratorio, radiografías y fotografías, y posterior a el o se realizó una
Se calculó la proporción de cepas resistentes a cada antimicro-
discusión. Los resultados de la calibración fueron >91% de acuerdo en las biano con relación a cada diagnóstico periodontal y se realizó la prueba χ2
mediciones de profundidad al sondaje y >82% para el nivel de inserción de Pearson para verificar si existían diferencias en los perfiles de sensibili-
dad con respecto al diagnóstico clínico.
Aislamiento e identificación de microorganismos
Las muestras subgingivales se tomaron de los 6 sitios más RESULTADOS
profundos en los pacientes con enfermedad periodontal y de un sitio por
cada sextante en los pacientes con gingivitis o sanos. Se removió la placa
En la tabla 1 se describe la frecuencia de los microorganismos
supragingival y se insertó una punta de papel estéril en el surco o bolsa aislados a los cuales se les realizaron pruebas de sensibilidad. Dentro de
durante 20 segundos, y las puntas se transfirieron a un frasco tapa rosca los anaerobios y capnófilos estudiados, fueron más prevalentes P. gingiva-
con el medio de transporte VMGA III para luego ser procesadas máximo lis y P. intermedia/nigrescens que predominaron en los pacientes con perio-
Sensibilidad de Periodontopáticos en Colombia
dontitis. Con respecto a los bacilos Gram negativos facultativos, fueron
más frecuentes bacterias de la familia Enterobacteriaceae que las no fer-
Tabla 2. Perfil de Resistencia de microorganismos periodontopáticos e inusuales de ac-
mentadoras. En los pacientes con gingivitis o sanos fue muy baja la fre-
uerdo al diagnóstico periodontal.
cuencia de aislamiento de las bac-
terias periodontopáticas y Gram
negativas entéricas estudiadas.
Los perfiles de resisten-
cia de los organismos evaluados A. actinomycetemcoitans
frente a los antimicrobianos, de P. gingivalis
acuerdo al diagnóstico periodon- P. intermedia/nigrescens
tal se presentan en la tabla 2. A. T. forsythia
actinomy-cetemcomitans fue no- Enterobacteriaceae
tablemente sensible a la mayoría Bacilos Gran negativos
de los antibióticos, exceptuando el no fermentadores
metronidazol y la clindamicina. Los
microorganismos anaerobios es-
trictos mostraron poca resistencia a Microorganismo
los antimicrobianos, aunque con la A. actinomycetemcomitans
amoxicilina se encontró resistencia P. gingivalis
de las especies de Prevotella. La P. intermedia/nigrescens
mayoría de los microorganismos T. forsythia
de la familia Enterobacteriaceae
fueron resistentes a la amoxicilina,
En todos los casos, p > 0.05, prueba χ2 cuadrado de Pearson.
PC: Periodontitis Crónica, PA: Periodontitis Agresiva.
mientras que a la tetraciclina cerca de la cuarta parte presentaron resist-
Los valores para cada microorganismo se presentan en n resistentes/n total (% de resis-tencia).
encia. En contraste, la ciprofloxacina fue altamente efectiva en las
*Los bacilos Gram negativos no fermentadores no fueron probados contra la amoxicilina debido a su
pruebas in vitro contra todos los bacilos Gram negativos entéricos. No
naturaleza resistente a este antimicrobiano.
se encontraron diferencias estadísticamente significativas en las propor-
ciones de bacterias resistentes según el diagnósico periodontal (prueba
Tabla 3. Concentraciones Inhibitorias Mínimas (μg/ml) de los antibióticos probados con-
χ2 de Pearson).
tra microorganismos periodontopáticos de pacientes con Enfermedad Periodontal.
La tabla 3 presenta los rangos de CIM, la CIM50 y CIM90 de
cinco patógenos periodontales contrastado de acuer-
do al diagnóstico de periodontitis crónica o agresiva. Microorganismo
P. gingivalis y T. forsythia exhibieron una gran sensibi-
<0.016 - >256
<0.002 - 0.023
lidad a los fármacos probados, pues se observan CIM A. actinomycetemcomitans
muy bajas. A. actinomycetemcomitans mostró CIM90
<0.016 - >256
altas frente a amoxicilina, metronidazol y clindamicina. P. gingivalis
P. intermedia/nigrescens presentó altas CIM90 para ci-
<0.016 - >256
<0.002 - >32
<0.016 - >256
profloxacina y metronidazol.
P. intermedia/nigrescens
La tabla 4 muestra los rangos de CIM, la
<0.002 - 0.002
T. forsythia
CIM50 y CIM90 de Enterobacteriaceae y de los baci-
los Gram negativos no fermentadores a los antimicro-
bianos. La ciprofloxacina exhibió los mejores resulta-
dos al inhibir el 50 y el 90% de los aislados de estos
organismos con unas concentraciones muy bajas. En A. actinomycetemcomitans
contraste, las especies de Enterobacteriaceae mos-
<0.016 - >256
<0.016 - >256
<0.016 - >256
traron CIM50 y CIM90 muy altas, lo que indica la alta P. gingivalis
resistencia de estos organismos a la amoxicilina. En
<0.016 - >256
<0.016 - >256
los bacilos Gram negativos no fermentadores no se P. intermedia/nigrescens
probó la amoxicilina ya que presentan una resistencia
constitutiva a este betalactámico
T. forsythia
En la tabla 5 se presentan algunas de las es-
pecies de Enterobacteriaceae resistentes a dos de los antibióticos proba-
En todos los casos, p > 0.05, prueba χ2 cuadrado de Pearson.
dos. Enterobacter cloacae y las especies de Klebsiella además de haber
PC: Periodontitis Crónica, PA: Periodontitis Agresiva.
sido las más prevalentes entre todos los inusuales, tuvieron los
niveles de resistencia más altos a la amoxicilina.
Tabla 1. Microorganismos estudiados para sensibilidad in vitro de acuerdo al diagnós-
tico periodontal.
Periodontitis Periodontitis Sanos y/ó
Crónica Agresiva Gingivitis Total
A. actinomycetemcomitans
P. gingivalis
P. intermedia/nigrescens
T. forsythia
Enterobacteriaceae
Bacilos Gran negativos
no fermentadores
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008
Jaramillo Echeverri A y cols
Tabla 4. Concentraciones Inhibitorias Mínimas (μg/ml) de los antibióticos probados con-
de este microorganismo a los antibióticos probados, lo que se explicaría
tra microorganismos inusuales de pacientes con Enfermedad Periodontal.
por el uso de antibióticos de forma indiscriminada, o por el hecho de que
este estudio es más reciente, y el tiempo juega un papel importante en la
evolución de los mecanismos de resistencia adquiridos por las bacterias,
mas aún en las que crecen en biopelículas como es el caso de la micro-
biota subgingival.
En una investigación publicada recientemente, se evaluó la re-
Enterobacteriaceae
0.16 - >256 0.38 - >256 <0.002 - >32 <0.002 - 0.47 0.96 - >256
sistencia de 5 bacterias periodontopatógenas a 10 antimicrobianos en 20
pacientes con periodontitis crónica, mediante las técnicas de difusión de
disco y microdilución en caldo. En ese estudio se encontró que el 25%
1 - >256 <0.002 - 1.5 0.006 - 0.125
de 8 aislados de T. forsythia fueron resistentes a la ciprofloxacina(5). En
Bacilos Gram negativos
contraste, no se encontró resistencia de T. forsythia a la ciprofloxacina,
no fermentadores
esta bacteria mostró alta sensibilidad a los antimicrobianos probados y
sólo una cepa fue resistente a la azitromicina (tabla 2).
En todos los casos, p > 0.05, prueba χ2 cuadrado de Pearson.
Se encontró una baja prevalencia de resistencia de P. gingiva-
PC: Periodontitis Crónica, PA: Periodontitis Agresiva.
lis a tetraciclina, metronidazol, amoxicilina y azitromicina y se encontra-
*Los bacilos Gram negativos no fermentadores no fueron probados contra la amoxicilina debido a su
ron proporciones similares de cepas sensibles de P. gingivalis compara-
naturaleza resistente a este antimicrobiano.
das con los hallazgos de un estudio previo en población colombiana,
en abscesos periodontales(22). Similares resultados fueron reportados en
Tabla 5. Especies de Enterobacteriaceae resistentes a Amoxicilina y Tetraciclina.
el estudio España-Holanda(3). Sin embargo en un estudio que evaluó la
sensibilidad por otros métodos pruebas (difusión de disco y microdilución
en caldo) se reportó una alta resistencia de este microorganismo a la
Amoxicilina Tetraciclina
clindamicina y la ciprofloxacina(5). Aunque las técnicas no son compara-
Enterobacter cloacae (23)
bles, es importante señalar que las CIM cuando son determinadas por
Klebsiella pneumoniae (17)
técnicas de E-test son más bajas que cuando lo son por otros métodos
Klebsiella oxytoca (11)
de prueba(23).
Enterobacter gergoviae (11)
En comparación con resultados previos del estudio de
Serratia liquefaciens (6)
abscesos periodontales en Colombia(22), en este se obtuvieron mayores
proporciones de cepas resistentes de P. intermedia/nigrescens a tetraci-
clina, metronidazol y azitromicina. Se encontró en pacientes con
periodontitis crónica 13% de resistencia para Tetraciclina, 5% para Az-
itromicina y 9% para Metronidazol contra 0% en el reporte de abscesos.
El tratamiento antimicrobiano de la enfermedad periodontal En el caso de la amoxicilina los resultados fueron similares (13.6% en
requiere de la evidencia científica que demuestre su eficacia clínica(15). periodontitis crónica contra 14.2% en el reporte de abscesos). P. inter-
Los efectos de un determinado tratamiento antimicrobiano pueden media/nigrescens son señaladas en varios estudios con resistencia a los
presentarse mejor en unos pacientes que en otros y en este punto es betalactámicos debido a la presencia de enzimas betalactamasas(3,5), y
importante resaltar el tipo de microbiota subgingival que tienen los pa-
en algunos países esto ha conducido a sugerir terapias combinadas de
cientes. Winkel ha demostrado en un estudio previo, que el tratamiento betalactámicos con inhibidores de betalactamasas (amoxicilina/ácido
con amoxicilina mas metronidazol parece ser mas efectivo en pacientes clavulánico). Aunque los resultados de este estudio nos muestran una
con periodontitis crónica por P.gingivalis(16). Sin embargo no sólo conocer resistencia baja a la amoxicilina, es importante continuar vigilando el
la microbiota presente sino el perfil de sensibilidad que presentan los comportamiento de este antimicrobiano en las especies de Prevotella
microorganismos a determinados antimicrobianos puede aportar mayor aisladas.
claridad acerca de la conducta terapeútica a seguir.
Los bacilos Gram negativos entéricos estudiados mostraron
La sensibilidad in vitro de las bacterias periodontopáticas ha altos niveles de sensibilidad a la ciprofloxacina y variados a la amoxicilina
sido evaluada por otros autores y se ha discutido la diferencia entre y tetraciclina tal como se ha visto previamente(9,24,25). En este estudio se
los perfiles de sensibilidad de algunas de estas bacterias en diferentes encontraron especies de los géneros Klebsiella, Enterobacter y Serra-
poblaciones(17). En el presente estudio se usó el E-test® para la deter-
tia resistentes a la amoxicilina, lo que es frecuente en estos géneros
minación de la CIM de los antimicrobianos probados, pues este método debido a la producción de betalactamasas que degradan activamente
ha sido ampliamente usado y validado en bacterias aisladas de la micro-
este antibiótico. Es por esto que las CIM observadas en este tipo de
aislados fueron muy altas y son comparables a las observadas en cepas
En este estudio se encontró una baja prevalencia de cepas de asociadas a infecciones nosocomiales(26,27). Aunque el papel que juegan
A. actinomycetemcomitans resistentes a tetraciclina, hallazgo que coin-
los bacilos Gram negativos entéricos en la enfermedad peridontal aún no
cide con el estudio de van Winkelhoff en el que se compararon las pro-
está claramente dilucidado, algunos autores han sugerido que la presen-
porciones de resistencia entre periodontopáticos de Holanda y España(3). cia de estas bacterias en la bolsa periodontal no sólo podrían retrasar el
Resultados similares se encontraron para la amoxicilina y para la azitro-
tratamiento de la enfermedad periodontal sino que también podría tener
micina, pues cerca de la tercera parte de los aislados en ambos estudios importancia como foco de infecciones para el hombre(28). El hallar este
fueron resistentes a estos antibióticos. En contraste, para el metronidazol tipo bacterias y tan resistentes a antibióticos comúnmente usados en
y la clindamicina se encontró una mayor proporción de resistencia de este enfermedad periodontal, debe ser tema de estudios mas profundos en
microorganismo en el presente estudio que en el europeo. Esta misma nuestra población.
observación fué reportada por otro grupo(6). La alta resistencia al metro-
Los hallazgos de los resultados in vitro no necesariamente re-
nidazol de este microorganismo ha sido explicada por el hecho de que el presentan lo que debe ocurrir en el tejido in vivo. Sin embargo, sugieren
metabolito hidroxilado de este fármaco es 3 a 4 veces más activo contra que la terapia combinada de amoxicilina y metronidazol tiene un soporte
anaerobios estrictos que contra este tipo de bacteria capnófila(19,20).
para su uso como terapia coadyuvante en pacientes con periodontitis
Al comparar la CIM90 del A. actinomycetemcomitans reporta-
asociada a microorganismos anaerobios, mientras que cuando existen
da en un estudio con 25 pacientes brasileros con periodontitis agresiva(21)
organismos inusuales el uso de la ciprofloxacina sería más efectivo.
con la de este estudio (tabla 3), se observó una mayor CIM90 en los ais-
lados colombianos para amoxicilina (2 en Brasil, vs. >256 en Colombia), AGRADECIMIENTOS
tetraciclina (1.5 vs. 3), clindamicina (8 vs. >256) y metronidazol (>32 vs
>256). Esto muestra que en nuestro país, a pesar de presentar unas con-
Manifestamos nuestros agradecimientos a los odontólogos
diciones socioculturales semejantes a Brasil, hay una mayor resistencia periodoncistas participantes en los diferentes Centros: Alexandra Barón,
Sensibilidad de Periodontopáticos en Colombia
Universidad El Bosque; Astrid Giraldo, Instituto de Ciencias de la Salud;
Este estudio fue financiado parcialmente por el Instituto Co-
Sergio Mantilla y Luz Elena Archila, Universidad Santo Tomás; Ferney lombiano para el Desarrollo de la Ciencia y la Tecnología, Francisco José
González, Universidad Metropolitana; Antonio Díaz, Universidad def de Caldas - COLCIENCIAS, No. 1308-04-13001.
Cartagena; Alejandro Botero, Universidad de Antioquia y Tatiana Chacón,
Universidad Autónoma de Manizales.
1. Haffajee AD. Systemic antibiotics: to use or not to use in the treatment of periodontal 16. Winkel EG, van Winkelhoff AJ, Timmerman MF, Van d, V, Van der Weijden GA. Amoxi-
infections. That is the question. J Clin Periodontol 2006; 33:359-361.
cillin plus metronidazole in the treatment of adult periodontitis patients. A double-blind
2. Slots J. Systemic antibiotics in periodontics. J Periodontol 2004; 75:1553-1565.
placebo-controlled study. J Clin Periodontol 2001; 28:296-305.
3. van Winkelhoff AJ, Herrera D, Oteo A, Sanz M. Antimicrobial profiles of periodontal 17. van Winkelhof AJ, Her era GD, Winkel EG, lemijn-Kippuw N, Vandenbroucke-Grauls CM,
pathogens isolated from periodontitis patients in The Netherlands and Spain. J Clin Peri-
Sanz M. Antimicrobial resistance in the subgingival microflora in patients with adult periodonti-
odontol 2005; 32:893-898.
tis. A comparison between The Netherlands and Spain. J Clin Periodontol 2000; 27:79-86.
4. Haffajee AD, Socransky SS. Microbial etiological agents of destructive periodontal dis-
18. Citron DM, Ostovari MI, Karlsson A, Goldstein EJ. Evaluation of the E test for suscep-
eases. Periodontol 2000 1994; 5:78-111.
tibility testing of anaerobic bacteria. J Clin Microbiol 1991; 29:2197-2203.
5. Lakhssassi N, Elhajoui N, Lodter JP, Pineill JL, Sixou M. Antimicrobial susceptibility 19. Pavicic MJ, van Winkelhoff AJ, de GJ. In vitro susceptibilities of Actinobacillus actino-
variation of 50 anaerobic periopathogens in aggressive periodontitis: an interindividual mycetemcomitans to a number of antimicrobial combinations. Antimicrob Agents Chem-
variability study. Oral Microbiol Immunol 2005; 20:244-252.
other 1992; 36:2634-2638.
6. Eick S, Pfister W, Straube E. Antimicrobial susceptibility of anaerobic and capnophilic 20. Walker CB. Selected antimicrobial agents: mechanisms of action, side effects and
bacteria isolated from odontogenic abscesses and rapidly progressive periodontitis. Int J drug interactions. Periodontol 2000 1996; 10:12-28.
Antimicrob Agents 1999; 12:41-46.
21. Tinoco EM, Beldi MI, Campedelli F, Lana M, Loureiro CA, Bellini HT, et al. Clinical
7. Rams TE, Babalola OO, Slots J. Subgingival occurrence of enteric rods, yeasts and sta-
and microbiological effects of adjunctive antibiotics in treatment of localized juvenile peri-
phylococci after systemic doxycycline therapy. Oral Microbiol Immunol 1990; 5:166-168.
odontitis. A controlled clinical trial. J Periodontol 1998; 69:1355-1363.
8. Helovuo H, Hakkarainen K, Paunio K. Changes in the prevalence of subgingival en-
22. Jaramillo A, Arce RM, Herrera D, Betancourth M, Botero JE, Contreras A. Clinical
teric rods, staphylococci and yeasts after treatment with penicillin and erythromycin. Oral and microbiological characterization of periodontal abscesses. J Clin Periodontol 2005;
Microbiol Immunol 1993; 8:75-79.
9. Slots J, Feik D, Rams TE. Prevalence and antimicrobial susceptibility of Enterobacte-
23. Eick S, Schmitt A, Sachse S, Schmidt KH, Pfister W. In vitro antibacterial activity
riaceae, Pseudomonadaceae and Acinetobacter in human periodontitis. Oral Microbiol of fluoroquinolones against Porphyromonas gingivalis strains. J Antimicrob Chemother
Immunol 1990; 5:149-154.
2004; 54:553-556.
10. 1999 International International Workshop for a Classification of Periodontal Diseases 24. Barbosa FC, Mayer MP, Saba-Chujfi E, Cai S. Subgingival occurrence and antimicro-
and Conditions. Papers. Oak Brook, Illinois, October 30-November 2, 1999. Ann Peri-
bial susceptibility of enteric rods and pseudomonads from Brazilian periodontitis patients.
odontol 1999; 4:i, 1-i112.
Oral Microbiol Immunol 2001; 16:306-310.
11. Slots J. Rapid identification of important periodontal microorganisms by cultivation. 25. Sedgley CM, Samaranayake LP. Antimicrobial susceptibility of oral isolates of En-
Oral Microbiol Immunol 1986; 1:48-57.
terobacter cloacae and Klebsiella pneumoniae from a southern Chinese population. Oral
12. National Committee for Clinical Laboratory Standards. Methods for Antimicrobial Microbiol Immunol 1998; 13:315-321.
Susceptibility Testing for Anaerobic Bacteria - Approved Standard Fifth Edition. NCCLS 26. Kiffer C, Hsiung A, Oplustil C, Sampaio J, Sakagami E, Turner P, et al. Antimicrobial
Document M11-A5. 2001. Ref Type: Generic.
susceptibility of Gram-negative bacteria in Brazilian hospitals: the MYSTIC Program Bra-
13. Clinical Laboratory Standards Institute. Performance standards for antimicrobial suscep-
zil 2003. Braz J Infect Dis 2005; 9:216-224.
tibility testing. Fifteenth Informational Supplement (M100-S15). 2005. Ref Type: Generic.
27. Paniara, Platsouka E, Dimopoulou H, Tzelepi E, Miriagou V, Tzouvelekis LS. Diversity
14. Thomson JM, Bonomo RA. The threat of antibiotic resistance in Gram-negative patho-
of beta-lactam resistance levels among related Klebsiella pneumoniae strains isolated in
genic bacteria: beta-lactams in peril! Curr Opin Microbiol 2005; 8:518-524.
an intensive care unit. J Chemother 2000; 12:204-207.
15. van Winkelhoff AJ. Antibiotics in periodontics: are we getting somewhere? J Clin Peri-
28. Barbosa FC, Irino K, Carbonell GV, Mayer MP. Characterization of Serratia marces-
odontol 2005; 32:1094-1095.
cens isolates from subgingival biofilm, extraoral infections and environment by prodigiosin
production, serotyping, and genotyping. Oral Microbiol Immunol 2006; 21:53-60.
Adriana Jaramillo Echeverri.
Trabajo recibido el 18/03/2008.
Aprobado para su publicación el 09/07/2008.
Fibromatosis Gingival Hereditaria en Niños. Caso Clínico
Hereditary Gingival Fibromatosis in Children. Case Report
Taj-Taj P1, Dolmestch C2
La Fibromatosis Gingival Hereditaria (FGH) es un agrandamiento de los tejidos gingivales poco frecuente, asociado a un componente genético, que
se hace evidente en el momento del recambio dentario. Puede generar diastemas, maloclusiones, dolor a la masticación, caries, enfermedad peri-
odontal, retardo en el recambio dentario, complicaciones fonéticas, de deglución y un importante compromiso estético y sicológico.
Paciente sexo femenino, 6 años de edad, con aumento de volumen gingival generalizado que compromete la estética y la función. Presenta retraso
en la erupción de dientes permanentes. Con antecedentes familiares de agrandamiento gingival. Se realiza el tratamiento periodontal quirúrgico y
odontopediátrico bajo anestesia general.
El diagnóstico precoz y el tratamiento oportuno de la FGH, son fundamentales para evitar complicaciones posteriores, más aún considerando la alta
tasa de recidiva de FGH en pacientes jóvenes.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 66-69, 2008.
Palabras clave: Fibromatosis gingival hereditaria, agrandamiento gingival en niños.
Hereditary Gingival Fibromatosis (HGF) is a rare gingival enlargement associated to a genetic condition. The onset of the disease it makes evident
during the eruption of permanent dentition. It could bring complications like diastemas, maloclussions, painful mastication, dental caries, periodontal
diseases, delayed eruption, phonetic difficulties, swallow complications and important esthetic and psychological problems.
A six years old female child shows a generalized gingival increase volumen that involves the esthetic and function. She shows a delayed eruption of
permanent incisors. There are familiar antecedents of gingival enlargement. Surgical Peridontal and Odontopediatric treatment under general anes-
thetic are made.
The early diagnosis and the opportune treatment of FGH are fundamental to avoid future complications, even more considering the high relapse rate
of FGH in young patients.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 66-69, 2008.
Key words: Hereditary gingival fibromatosis, gingival enlargement in children.
En base a su expresión clínica se han descrito la forma nodu-
Se utiliza el término "agrandamiento gingival" para describir lar, que se caracteriza por múltiples agrandamientos localizados a nivel
un incremento del tamaño gingival que puede ser causado por factores de las papilas interdentarias y la forma simétrica, la más común, que es
inflamatorios, consumo de medicamentos, enfermedades sistémicas o un agrandamiento gingival más uniforme(1).
por condiciones genéticas(1).
La FGH puede generar alteraciones que van desde dificulta-
La FGH, es una hiperplasia gingival idiopática, y se considera des fonéticas, alteraciones en la deglución, dolor a la masticación, pres-
como un tipo de agrandamiento gingival de baja prevalencia (1:750.000)
encia de diastemas y maloclusiones, retardo en el recambio dentario
(2,6). Según la actual clasificación de las enfermedades periodontales se y un importante compromiso estético. La retención de placa bacte-
enmarca dentro de las lesiones gingivales no asociados a Placa bacte-
riana generada por el agrandamiento gingival, puede contribuir tam-
riana de origen genético(3).
bién a la presencia de caries y de enfermedad periodontal. No menos
Está asociada a un componente autosómico dominante o re-
importantes son los efectos en el desarrollo emocional y sicológico del
cesivo. Puede presentarse como un cuadro aislado o como parte de niño(1,2,5,7).
varios síndromes. Se han reportados casos de FGH como parte de los
Histopatológicamente se observa un aumento del tejido
síndromes Zimmerman-Laband, Murray-Puretic-Drescher, Cowden, conectivo fibroso, con gruesas fibras de colágeno, con fibroblastos
Cross, y Rutherford entre otros(1,2). Puede presentarse asociada a jóvenes y escasos vasos sanguíneos. El epitelio es denso, con prolon-
hipertricosis, retraso mental y epilepsia, pero en ocasiones, la única gaciones papilares e hiperqueratosis. Se observan pequeñas partículas
manifestación clínica es el agrandamiento gingival(1,4).
calcificadas con tejido óseo metaplásico aislado y, ocasionalmente, se
La FGH se hace evidente durante la erupción de las piezas pueden observar zonas de ulceración e inflamación. Las característi-
permanentes especialmente los incisivos, pero en ocasiones se puede cas histológicas no son específicas, por lo que el diagnóstico se basa
manifestar en la dentición temporal(1,2).
en la historia y manifestaciones clínicas(4).
El tejido gingival se presenta aumentado de volumen, de
El tratamiento de la FGH dependerá de la severidad del caso.
color rosado, firme y que puede llegar a cubrir la totalidad de la corona Si el agrandamiento es mínimo, el debridamiento y cuidadoso control
y caras oclusales de las piezas dentarias. No existe sangramiento al de placa bacteriana pueden ser suficientes(1). En casos severos, el
sondaje ni presencia de exudado, presentando la encía su punteado tratamiento de elección es la extirpación quirúrgica mediante gingivec-
característico. El tejido puede ser tan firme y fibroso que a la palpación tomía. La restauración del contorno gingival fisiológico permite un mejor
su consistencia es similar al tejido óseo. La encía libre e insertada es-
control de placa bacteriana y con el o, una menor recurrencia y mejores
tán afectadas, pero el agrandamiento no excede mas allá de la unión resultados en el largo plazo(1,2).
1. Cirujano Dentista, Especialista en Periodoncia. Servicio Especialidades Odontológicas, Hospital San Carlos, Servicio Salud Ñuble. Ejercicio
privado de la profesión. Chile.
2. Cirujano Dentista, Especialista en Odontopediatría. Clínica Dental, Fundación Coanil, Chillán. Ejercicio privado de la profesión. Chile.
Fibromatosis Gingival Hereditaria en Niños
Algunos autores plantean que el mejor momento para reali-
zar el tratamiento es una vez que la toda dentición permanente está
presente, pues existe alta probabilidad de recurrencia en pacientes
jóvenes(2). Sin embargo, el tratamiento precoz a temprana edad tiene
con principal fundamento la prevención de consecuencias funcionales,
estéticas y sicológicas en el niño(1,2,5). Puede ser necesario repetir el
tratamiento quirúrgico debido a la alta recurrencia del cuadro, lo que
generalmente ocurre dentro de los 2 primeros años posteriores a la
gingivectomía(1,2).
Si bien la FGH es una patología de baja prevalencia, el
odontólogo debe estar capacitado para realizar un diagnóstico precoz y
una derivación oportuna, a fin de evitar futuras complicaciones.
Paciente sexo femenino de 6 años de edad. Asiste en com-
pañía de su madre, consultando por aumento de volumen progresivo
de las encías y retraso en la erupción de incisivos permanentes. El Figura 2. Vista oclusal maxilar, nótese la impronta de los incisivos inferiores en el tejido
aumento de volumen gingival comenzó al erupcionar las piezas tempo-
gingival maxilar.
rales, pero se ha hecho más evidente en el último tiempo, presentando
actualmente molestias y dolor a la masticación.
La madre se muestra preocupada por el severo compromiso
estético que sufre la niña, lo que la hace blanco de constantes burlas
por parte sus pares, afectando seriamente sus relaciones interperso-
No presenta antecedentes médicos de importancia ni con-
sume ningún tipo de medicamentos. Su desarrollo sicomotor es normal.
Existe el antecedente familiar de agrandamiento gingival (tío paterno).
Al examen clínico la encía se presenta aumentada de volu-
men en forma generalizada. De color rosado pálido, con presencia de
punteado, de consistencia firme y textura fibrosa, bordes redondeados
con pérdida del bisel característico y ubicación coronal al LAC cubrien-
do casi totalmente las piezas anteriores permanentes en proceso de
erupción (Figuras 1 y 2). Ausencia de sangramiento al sondaje, supu-
ración y signos de destrucción periodontal (movilidad, pérdida de inser-
ción, compromiso de furcación, migración y recesión gingival). Presen-
cia de seudo saco periodontal generalizado. Indice de placa bacteriana
Presenta poliobturaciones, caries de surco en primeros mo-
Figura 3. Radiografías retroalveolares que confirman la presencia de las piezas den-
lares permanentes en erupción, absceso vestibular en relación a la pie-
tarias permanentes bajo el tejido gingival.
za 5.5 con dolor intenso a la percusión, movilidad dentaria pieza 5.2 por
pronta exfoliación. Se solicitan radiografías retroalveolares totales para
confirmar la presencia y grado de desarrol o de las piezas permanentes
bajo el tejido gingival.
DIAGNÓSTICO: Fibromatosis Gingival Hereditaria Simétrica.
La paciente fue derivada a especialista Odontopediatra
para la resolución de la urgencia dental, efectuándose la exodoncia
de la pieza 5.5. Debido a la complejidad del caso y a que la paciente
era altamente aprehensiva, de difícil manejo y toleraba sesiones de
muy corta duración, se decide realizar el tratamiento periodontal
quirúrgico y odontopediátrico bajo anestesia general.
Se efectúa tratamiento periodontal no quirúrgico mediante
instrucción de higiene oral a la niña y a la madre y el debridamiento
maxilar y mandibular.
Posteriormente, bajo anestesia general, se procede al
tratamiento de operatoria dental planificado, seguido del tratamiento
periodontal quirúrgico. Se realiza gingivectomía a bisel externo. El te-
jido se presenta de consistencia muy firme y fibroso, lo que dificulta y
prolonga el procedimiento. Se priorizan los sectores anteriores maxi-
Figura 1. Imagen frontal, donde se observa una gruesa capa de tejido gingival, que lar y mandibular por consideraciones funcionales y estéticas para
impide la erupción de los incisivos permanentes.
permitir, además, la erupción de la piezas definitivas.
Para finalizar, la zona quirúrgica es protegida mediante ce-
mento quirúrgico periodontal.
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008
Taj-Taj P y Dolmestch C
El postoperatorio fue satisfactorio. Se mantuvo a la pa-
La paciente no asiste al control semestral programado y lo
ciente hospitalizada por 12 hrs. y posterior a ello, es dada de alta. Se hace después de de 1 año (6 meses de inasistencia). En esa oportuni-
prescribe colutorio de CHX. 0,12 % y analgesia en base a Ibuprofeno dad la encía se observa aumentada de volumen, pero en menor grado
400 mg. Se realiza un control a los 7 días con buena evolución, cica-
que al inicio del tratamiento. Presenta un índice de Placa bacteriana (75
trización normal de los tejidos periodontales y sin mayores molestias.
%). Se diagnostica recidiva parcial y leve de FGH y Gingivitis asociada
Son realizados controles semanales periódicos durante 2 me-
a placa bacteriana, por lo que la paciente es reingresada a tratamiento
ses, tras lo cual la paciente es reevaluada y dada de alta. Se establece periodontal.
terapia de soporte periodontal a los 6 meses, reiterando la necesidad
de realizar un buen control de placa bacteriana durante este período.
La FGH es una proliferación fibrosa de los tejidos gingivales
poco frecuente, asociado a un componente genético, que se hace
más evidente, como en este caso, en el momento del recambio den-
La FGH no es un cuadro agudo, ni representa una urgencia
odontológica real, pero en casos como este, en que el excesivo
agrandamiento gingival afecta a una niña en etapa de crecimiento
activo, tanto físico como sicológico, pueden verse afectados seria-
mente el desarrollo normal de los maxilares, la oclusión, las fun-
ciones de fonación, masticación, deglución y la estética, siendo este
último un componente importante en el desarrollo de la autoestima y
consecuente estabilidad sicológica y emocional.
Es por todo lo anterior, que la detección y derivación opor-
tuna por parte del odontopediatra y el diagnóstico precoz y tratami-
ento adecuado, con un manejo correcto de las técnicas quirúrgicas
por parte del periodoncista, son fundamentales para conseguir re-
sultados estéticos y funcionales óptimos en el tratamiento de un caso
La manifestación temprana de la FGH y todos los efectos
que el a conl eva, justifica la intervención temprana del caso.
La edad de la niña, su difícil manejo para la atención, lo
extensa y compleja de la intervención quirúrgica periodontal, además
de la necesidad de tratamiento odontopediátrico, hacen necesario su
manejo bajo anestesia general. Esta última, muestra ser una impor-
tante herramienta en la resolución de problemas periodontales que
requieren un manejo especial.
Pese a que los resultados obtenidos en el tratamiento de
este caso fueron óptimos inicialmente (estéticos y funcionales), la
recidiva parcial del agrandamiento gingival después de un año de
control, hace evidente la necesidad de una terapia de mantención
periodontal con intervalos de menor tiempo a los establecidos en un
principio, a fin de lograr un mayor compromiso del paciente y man-
tener un adecuado control y seguimiento.
Figuras 4 y 5. Imagen a las 4 semanas posterior a la cirugía, en que se observa la
presencia de los incisivos permanentes.
Figura 6. Vista frontal al control 1 año posterior a la cirugía, en la que se observa recidiva
en menor grado del agrandamiento.
Fibromatosis Gingival Hereditaria en Niños
1. Deangelo S, Murphy J, Claman L, Kalmar J. Hereditary Gingival Fibromatosis- A Re-
Pathogenesis, and Complications. A Literature Review J Periodontol 2005.76:3-10.
view. Compendium 2007. 28:138-144.
5. Baptista IP. Hereditary Gingival Fibromatosis a Case Report. J Clin Periodontol 2002:
2. Coletta R, Graner E. Hereditary Gingival Fibromatosis: A Systematic Review. J. Peri-
29: 871–874.
odotol 2006. 77:753-764.
6. Ramer M, Marrone J, Stahl B, Burakoff R. Hereditary Gingival Fibromatosis: Identifica-
3. International Workshop for Classification of Periodontal Diseases and Conditions. Ann tion, Treatment, Control. JADA 1996.27:493-495.
7. Bozzo L, Machado MA, de Almeida OP, Lopes MA, Colletta RD. Hereditary Gingival
4. Doufexi A, Mina M, Ioannidou E. Gingival Overgrowth in Children: Epidemiology, Fibromatosis: Report of three cases. J Clin Pediatr Dent 2000; 25:41-46.
Pablo Taj-Taj Caballero
Centro Especialidades Odontológicas CEO.
Av. Libertad 845 of. 506, Chillán. Chile.
Trabajo recibido el 22/05/2008.
Aprobado para su publicación el 09/07/2008.
The TH17 vs. TREG Imbalance in the Pathogenesis of
Periodontitis: New Approach for Dichotomy TH1 vs. TH2
Dezerega A1, Maggiolo S1, Garrido M1, Dutzan N2
For decades several authors have directed their efforts to elucidate the nature of the immune response in periodontitis. The subject has been matter
of controversy, and answers remain unclear. The present review intends to summarize the character of the inflammatory response in periodontitis, with
emphasis on the T helper imbalance produced during the development of the disease.
Rev Clin Periodoncia Implantol Rehabil Oral Vol 1(2); 70-72, 2008.
Key words: Periodontitis, immune response, Th1, Th2, Th17, Treg.
Nature of the inflammatory response in periodontitis
elimination of extracellular microorganisms, including helminths and
Periodontitis encompass multifactorial diseases involving
Immunohistological studies have clearly established that a T-
bacterial biofilms and the generation of an inflammatory response(1). cell/macrophage lesion identical to a delayed hypersensitivity reaction(13)
Periodontitis, chronic and aggressive subtypes, is usually related to occurs within 4 to 8 days of plaque accumulation in an experimental
polybacterial infection and three specific pathogens have been repeat-
gingivitis study(14). This synonymous with the early lesion described
edly identified as etiologic agents in the periodontal destruction: Aggre-
by Page and Schroeder(15) and with the putative stable lesion(16). The
gatibacter (Actinobacillus) actinomycetemcomitans (Aa), Porphyrom-
striking similarities between this early/stable periodontal lesions and
onas gingivalis (Pg) y Tannerella forsythia (Tf)(2). Bacterial biofilms have delayed-type hypersensitivity prompted the suggestion that cells with a
been shown to be the primary aetiological factor in the initiation of gin-
TH1 cytokine profile are the major mediators. Such a concept is consis-
gival inflammation and subsequent destruction of periodontal tissues(3). tent with the proposal that a strong innate immune response leads to
Although chronic bacterial and endotoxin exposure is a prerequisite the production of IL-12, which in turn leads to this TH1 response(8). The
for gingival inflammation and periodontal tissue destruction to occur, dominance of B-cells/plasma cells in the advanced/progressive lesion
its presence alone accounts for a relatively small proportion (i.e. 20%) would suggest a role for TH2 cells. Clearly, if the innate response is
of the variance in disease expression(4). According to a novel model of poor, low levels of IL-12 would be produced and a poor TH1 response
pathogenesis of periodontitis, this is not sufficient to explain disease may occur which may not then contain the infection(17).
initiation and progression(5,6,7). The major component of soft- and hard-
To test this hypothesis, several investigators have attempted
tissue destruction associated with periodontitis is the result of activation to delineate the TH1/TH2 profile in periodontal disease. Pilon et al.(18)
of the host's immune-inflammatory response to the bacterial chal enge, demonstrated lower levels of IL-2 in the gingival crevicular fluid of pe-
it is the nature of the inflammatory responses which determines the
riodontitis sites compared with healthy sites, and Fujihashi et al(19) have
destructive character of the disease(8).
shown that gingival mononuclear cells from adult periodontitis patients
Based upon histopathological features, inflammatory process-
produce IL-4 and IL-5 but not IL-2. Peripheral blood mononuclear cells
es developed in the periodontitis may be divided into three phases: an from periodontitis patients stimulated with mitogens resulted in reduced
acute phase, an immune response and a chronic phase(5). The transition IFN-γ secretion and mRNA expression of IFN-γ and IL-2. At the same
process from gingival health to early inflammatory changes is character-
time, significantly higher levels of IL-5 and granulocyte/macrophage-
ized by a local increase in vascular permeability, redness, swel ing and colony stimulating factor (GM-CSF) were observed(20). Significantly less
by the recruitment and activation of polymorphonuclear granulocytes IL-2 activity was also found in peripheral blood mononuclear cell cul-
(PMNs)(9). In the course of this acute phase, several products modu-
tures stimulated with P. gingivalis and F. nucleatum(21). Increased Th2 re-
late vasodilatation (e.g. bradykinin and prostaglandins), vascular per-
sponse in periodontitis has also been reported. Memory T-cel s from the
meability (e.g. histamine and leukotriene) and additional recruitment of peripheral blood of adult periodontitis patients with high anti- P. gingivalis
inflammatory cel s through chemotaxis (e.g. complements products and titers stimulated in vitro with P. gingivalis have been shown to produce
chemokines)(5). The subsequent immune response starts when antigen-
higher amounts of IL-4 than cells from healthy subjects(22). Yamazaki et
presenting cells become involved presenting the foreign microorga-
al.(23) demonstrated an increase percentage of IL-4+ cells proportional
nisms or antigens to immunocompetent cells such as T lymphocytes. to an increasing B-cell/T-cell ratio. Another study suggested a role for
This leads to the expansion of antibody-secreting plasma cells and the IL-4 and TH2 responses in periodontitis lesions by the demonstration
development of a chronic lesion(10).
of concentrations of IgG4 many times higher in sites of active perio-
dontitis than in serum, as well as significantly elevated concentrations
compared with stable lesions(24). Seymour et al.(25) proposed that due to
the shift in lymphocyte populations in the inflammatory infiltrate from
Response TH1 vs. TH2 in periodontitis
predominantly T-cells in gingivitis to an increased proportion of B-cells
in periodontitis, susceptibility to periodontal disease progression may
Based on their pioneer work, Mosmann and Coffman pro-
involve a predominantly TH2-like response. In contrast to these studies,
posed that T helper cells could be divided into two distinct subsets, T Ebersole and Taubman(26) found that IFN-γ message was prominently
helper type 1 (TH1) and TH2, characterized by distinct cytokine profiles expressed by disease gingival tissue cells. Cytokine profiles of cells ex-
and effectors functions (11). TH1 cells secrete interferon gamma (IFN-γ) tracted from six patients were consistent with TH1 cells in that they were
and tumor necrosis factor alpha (TNF-α), which are critical for the eradi-
IL-2 and IFN-γ-positive but negative for IL-4 and IL-5.
cation of intracellular pathogens, while Th2 cells produce interleukin-4,
Another study comparing the local and systemic responses in
-5, -6, and -13, which are essential for optimal antibody production and periodontitis patients with so-called terminal dentition periodontitis dem-
1. Instructor Área de Endodoncia, Depto. de Odontología Conservadora, Facultad de Odontología, Universidad de Chile. Chile.
2. Ayudante Área de Periodoncia, Depto. de Odontología Conservadora, Facultad de Odontología, Universidad de Chile. Chile.
The TH17 vs. TREG Imbalance in the Pathogenesis of Periodontitis: New Approach for Dichotomy TH1 vs. TH2
onstrated reduced TH2 responses. Levels of prostaglandin E2 (PGE2), in mucosa associated lymphoid tissue, while in secondary lymphoid
IL-1β and IL-2 in the gingival crevicular fluid samples were highest, fol-
organs, TGF-β may be provided by T cells themselves as suggested
lowed by lower levels of TNF-α and IFN-γ and even lower of IL-4 and by recent findings(48). The role of TGF-β in the development of these
cells is particularly interesting, as TFG-β is also important for driving
the generation of Treg cell. Thus, TFG-β will promote the differentiation
of inhibitory Treg; however, in the presence of additional inflammatory
TH17 cells and IL-17
signals such as IL-6, TH17 cells will be generated. Thus, IL-6 represent
a crucial switch for controlling the differentiation of CD4+ T cells to the
In light of recent data, the TH1/TH2 dichotomy is now being TH17 or Treg lineages(34).
revisited. The discovery of the IL-17 family of cytokines and the analysis
The relationship between TH17 and Treg cells, suggest that
of IL-23-mediated effector functions on T cells have suggested the ex-
there is not only a functional antagonism but there is a dichotomy in
istence of an additional subset of CD4+ T cells that produce IL-17(28,29). their generation as well(34). Therefore, Treg cells and TH17 effector arise
During the past few years, it has become apparent that IL-12, STAT4 in a mutually exclusive fashion, depending on whether they are acti-
and IFN-γ, and therefore Th1 cells, are not the primary instigators of vated in the presence of TGF-β or TGF-β plus IL-6. At the steady-state
model inflammatory diseases(30). Rather, the pathogenic cells in these level or in the absence of any inflammatory insult, TGF-β produced by
models of disease are induced in response to signals provided in vivo the immune system will suppress the generation of effector T cells and
by the IL-12-like cytokine IL-23, and characterized by production of a wil induce Foxp3+ regulatory T cel s thereby maintaining self-tolerance.
suite of cytokines, chemokines, effector molecules and transcription fac-
However, on infection or inflammation, IL-6 induced by the activated
tors distinct from that of TH1 cells(29,30,31). One of the genes most highly innate immune system will suppress the generation of TGF-β-induced
expressed in these effector cells is the proinflammatory cytokine IL-1(29). Treg cells and will induce a pro-inflammatory T-cell response predomi-
Consequently, they have been termed TH17 cells. These TH17 cells nated by TH17 cells. This is consistent with the in vivo observation that
have been recognized as key mediators of inflammation and tissue destructive arthritis in IFN-γ-deficient mice can be treated with anti-IL-
damage in several animal models of human diseases(29,30,31). Analogous 17, and neutralization of IL-17 results in the generation of CD24+CD25+
to the central roles played by T-bet and GATA3 in generating TH1 and regulatory T cells(49). So the balance between TH17 and Treg may be
TH2 cells, respectively(32), RORγt is considered to be the transcription important in the development/prevention of inflammatory and autoim-
factor responsible for guiding the development of TH17 cells(33), Trans-
mune diseases(50).
forming growth factor β (TGF-β) and IL-6 are cytokines that also guiding
the development of TH17 cells(34). The role of TH17 cells is very impor-
tant for responses against specific pathogens that are poor eliminated TH17, Treg cells and IL-17 in periodontitis
by TH1 and TH2 responses (Korn et al. 2007).
Recent studies showed that IL-21 also controls the generation
The infiltrate present in periodontal diseases contains mono-
of TH17 cells(35,36,37). They showed that IL-21, in combination with TGF-β, nuclear cells, mainly transmigrated mononuclear phagocytes and
induces IL-17 production from naive CD4+ T cells. These papers also lymphocytes(51). Previous studies demonstrated the presence and the
demonstrated that IL-6 or IL-21 could induce TH17 cells themselves to role of IL-17 in the pathogenesis of periodontitis(52,53,54). Vernal et al.(55)
produce IL-21. Such endogenous production of IL-21 by TH17 cells ap-
studied the levels of IL-17 in patients with chronic periodontitis and
peared to be biologically significant, because the number of IL-17-pro-
found that they were significantly increased in both gingival crevicular
ducing cells generated by TGF-β and IL-6 was reduced in the absence fluid and in supernatants of cellular cultures of gingival tissue, compared
of IL-21/IL-21R signalling(35,36). Thus, IL-6 can elicit IL-21 production by with the control group. Johnson et al.(52) demonstrated a positive correla-
CD4+ cells, which then functions in an autocrine loop to amplify the tion between levels of IL-17 within solubilised gingival biopsies and the
TH17 response in a similar way to IL-4 for Th2 and IFN-γ for TH1. It is progression of gingivitis to periodontitis. IL-17 treatment of human gin-
possible that TH17 cel s induced by TGF-β and either IL-6 or IL-21 make gival fibroblast has also been observed to lead to IL-6 production, which
qualitatively different contributions to the development of inflammation may contribute to local inflammation(55). Takahashi et al.(53) suggest that
depending on the pathogen and affected tissue(38).
tissue destruction in periodontitis lesion results from major secretion of
IL-17, or IL-17A, is the founding member of a six-member fa-
IL-6, induced by IL-17. The above findings have led to the suggestion
mily of cytokines (IL-17 A-F)(39,40). IL-17A and IL-17F are proinflammatory that IL-17 may play a pivotal role in the initiation or maintenance of an
cytokines, and have important action over different cells, inducing ex-
pression of cytokines (e.g. IL-6, GM-CSF, G-CSF, IL-1β, TNF), chemo-
Natural Treg are key regulators of immune responses, express
kines (e.g. IL-8, MCP-1) and MMPs (41). IL-17 plays a particularly signif-
CD4 and CD25 surface markers, and regulate the activation, prolifera-
icant role in regulating neutrophil recruitment and granulopoiesis(39,42).
tion, and effector function of activated conventional T cells. Previous
studies found that many of the CD4+ T-cell clones derived from either
gingival tissue or peripheral blood express the Foxp3 gene(56,57). Okui et
TH17 and Treg cells
al. (58) showed that Foxp3+ cells were also identified in periodontitis le-
sions. The cells were restricted to the CD4+ populations.
Recently, CD4+ CD25+ regulatory T cells (Treg) have been
described as one distinct subset from T cells(43). Pathogenic autoimmu-
nity is control ed in healthy individuals by a specialized subset of T cel s Final Considerations
named Treg cells(44). Treg cell differentiation and function are driven by
the transcription factor Foxp3 and they have an anti-inflammatory role
Several investigators have tried to establish the predominant
in maintaining tolerance to self components by contact-dependent su-
T helper profile during periodontitis. Although there has not been con-
ppression or releasing anti-inflammatory cytokines such as IL-10 and sensus about it, in the majority of the literature it was accepted that
TGF-β(43). Treg cell development is closely related to the generation of a Th1 profile could be mediator of the early/stable lesion, and a Th2
TH17 cells. TFG-β induces the differentiation of Treg cells(45), whereas profile could be responsible of the progression of the disease. With the
TFG- β in combination with IL-6(46) or IL-21(35) results in the differentiation discovery of the Th17 response, new insights have been made in the
of TH17 cells.
pathogenesis of the periodontitis, suggesting that Th17 population may
The participation of TGF-β, secreted by Treg cells, in the dif-
play a major role in the initiation and maintenance of the inflammatory
ferentiation of TH17 cells has been recently evaluated(35). Subsequent-
response typical of this disease.
ly, it was shown that IL-17 production by naïve CD4+ T cells could be
driven by TGF-β and IL-6(47). It is clear that TGF-β is readily available
Rev. Clin Periodoncia Implantol Rehabil. Oral Vol. 1 (2); 2008
Dezerega A. y cols
1. Salvi G., Lang N. Host response modulation in the manegement of periodontal diseases. 36. Nurieva, Yang XO, Martinez G et al. Essential autocrine regulation by IL-21 in the gen-
J Clin Periodontol 2005,32(Suppl. 6):108-129.
eration of inflammatory T cells. Nature 2007,448:480-483.
2. Socransky SS, Haf ajee AD, Cugini MA, Smith C, Kent RLJr. Microbial complexes in 37. Zhou L, Ivanov I , Spolski R et al. IL-6 programs T(H)-17 cel dif erentiation by promoting
subgingival plaque. J Clin Periodontol 1998,25:134-144.
sequential engagement of the IL-21 and Il-23 pathways. Nat Immunol 2007,10:1038-1488).
3. Haffaje AD, Socransky SS. Microbial etiological agents of destructive periodontal dis-
38. Deenick EK, Tangye SG. IL-21: a new player in Th17-cel dif erentiation. Immunol Cell
eases. Periodontology 2000 1994,5:78-111.
4. Grossi SG, Zambon JJ, Ho AW, et al. Assessment of risk for periodontal disease. I. Risk 39. Aggarwal S, Gurney AL. IL-17: prototype member of an emerging cytokine family. J
indicators for attachment loss. J Periodontol 1994,65:260-0267.
Leukoc Biol 2002,71:1-8.
5. Offenbacher S. Periodontal diseases: pathogenesis. Ann Periodontol 1996,1:821-878.
40. Kawaguchi M, Adachi M, Oda N et al. IL-17 cytokine family. J Al ergy Clin Immunol
6. Page RC, Kornman KS. The pathogenesis of human periodontitis: and introduction. 2004,114:1265-1273.
Periodontol 2000 1997,14:9-11.
41. Kol s JK, Linden A. Interleukin-17 family members and inflammation. Immunity
7. Baker PJ. The role of immune responses in bone loss during periodontal diseases. Mi-
crobes Infect 2000,2:1181-1192.
42. Moseley TA, Haudenschild Dr, Rose L, Reddi AH. Interleukin-17 family and IL-17 recep-
8. Gemmel E, Yamazaki K, Seymour GJ. Destructive periodontitis lesions are determined by tors. Cytokine Growth Factor Rev 2003,14:155-174.
the nature of lymphocytic response. Crit Rev Oral Biol Med 2002,13:17-34.
43. Sakaguchi S, Ono M, Setoguchi R et al. Foxp3+ CD25+ CD4+ natural regulatory T cells
9. Delina AJ, Van Dyke TE. Origin and function of the cellular components in gingival crevice in dominant self-tolerance and autoimmune disease. Immunol Rev 2006,212:8-27.
fluid. Periodontology 2000,31:55-76.
44.Sakaguchi S. Naturally arising CD4+ regulatory T cells for immunologic self-tolerance
10. Gemmel E, Seymour GJ. Immunregulatory control of Th1/Th2 cytokine profiles in peri-
and negative control of immune responses. Annu Rev Immunol 2004,22:531-562.
odontal diseases. Periodontology 2000 2004,35:21-41.
45. Chen W et al. Conversion of peripheral CD4+CD25+ naive T cells to CD4+CD25+ regulatory
11. Mosmann TR, Coffman RL. TH1 and TH2 cells: different patterns of lymphokine secre-
T cells by TGF-B induction of transcription factor Foxp3. J Exp Med 2003,198:1875-1886.
tion lead to different functional properties. Annu Rev Immunol 1989,7:145-173.
46. Veldhoen M, Hocking RJ, Atkins CJ, Locksley RM, Stockinger B. TGF-B in the context of
12. Abbas AK, Murphy KM, Sher A. Functional diversity of helper T lymphocytes. Nature an inflammatory cytokine milieu supports de novo dif erentiation of IL-17-producing T cel s.
13. Poulter LW, Seymour GJ, Duke O, Janossy G, Panayi G. Immunohistological analysis of 47. Mangan PR, Har ington LE, O'Quinn et al. Transforming growth factor-beta induces
delayed-type hypersensitivity in man. Cell Immunol 1982,74:358-369.
development of the T(H)17 lineage. Nature 2006,441:231-234.
14. Seymour GJ, Gemmel E, Walsh LJ, Powell RN. Immunohistological analysis of experi-
48. Li MO, Wan YY, Flavell RA. T cell-produced transforming growth factor-beta1 controls T
mental gingivitis in humans. Clin Exp Immunol 1988,71:132-137.
cell tolerance and regulates Th1- and Th17-cell differentiation. Immunity 2007,26:579-591.
15. Page RC, Schroeder HE. Pathogenesis of inflammatory periodontal disease. A sum-
49. Nardelli DT et al. Association of CD4+ CD25+ T cells with prevention of severe destruc-
mary of current work. Lab Invest 1976,34:235-249.
tive arthritis in Bor elia burgdorferi-vaccinated and chal enged gamma interferon-deficient
16. Seymour GJ, Greenspan JS. The phenotypic characterization of lymphocyte subpopula-
mice treated with anti-interleukin-17 antibody. Clin Diag Lab Immunol 2004,11:1075-1084.
tions in established human periodontal disease. J Periodontol 1979,14:29-46.
50. Homey B. After TH1/TH2 now comes Treg/TH17: significance of T helper cells in im-
17. Gemmell E, Seymour GJ. Cytokine profiles of cells extracted from humans with peri-
mune response organization. Hautarzt 2006,57:730-732.
odontal diseases. J Dent Res 1998,77:16-26.
51. Zappa V, Reinking-Zappa M, Garf H, Espeland M. Cell populations and episodic peri-
18. Pilon M, Williams-Miller C, Cox DS. Interleukin-2 levels in gingival crevicular fluid in peri-
odontal attachment loss in humans. J Clin Periodontol 1991,18:508-515.
odontitis. J Dent Res 1991,70:550.
52. Johnson RB, Wood N, Serio FG. Interleukin-11 and IL-17 and the pathogenesis of peri-
19. Fujihashi K, Kono Y, Yamamoto M et al. Interleukin production by gingival mononuclear odontal disease. J Periodontol 2004,75:37-43.
cells isolated from adult periodontitis patients. J Dent Res 1991,70:550).
53. Takahashi K, Azuma T, Motohira H, Kinane DF, Kitetsu S. The potential role of interleukin-
20. Sigusch B, Klinger G, Glockmann E, Simon HU. Early-onset and adult periodontitis 17 in the immunopathology of periodontal disease. J Clin Periodontol 2005,32:369-374.
associated with abnormal cytokine production by activated T lymphocytes. J Periodontol 54. Vernal R, Dutzan N, Chaparro A, Puente J, Valenzuela MA, Gamonal J. Levels of inter-
leukin-17 in gingival crevicular fluid and in supernatants of cellular cultures of gingival tissue
21. Gemmel E, Seymour GJ. Modulation of immune resposes to periodontal bacteria. Curr from persons with chronic periodontitis. J Clin Periodontol 2005,32:383-389.
Opin Periodontol 1994,28-38.
55. Beklen A, Ainola M, Hukkanen M, Gurgan C, Sorsa T, Kont inen YT. MMPs, IL-1 and
22. Aoyagi T, Sugawara-Aoyagi M, Yamazaki K, Hara K. Interleukin 4 (IL-4) and IL-6-producing TNF are regulated by IL-17 in periodontitis. J Dent Res 2007,86:347-351.
memory T-cells in peripheral blood and gingival tissues in periodontitis patients with high serum 56. Nakajima T, Ueki-Maruyama K, Oda T et al. Regulatory T-cells infiltrate periodontal dis-
antibody titers to Porphyromonas gingivalis. Oral Microbiol Immunol 1995,10:304-310.
ease tissues. J Dent Res 2005,84:639-643.
23. Yamazaki K, Nakajima T, Aoyagi T, Hara K. Immunohistological analysis of memory T 57. Ito H, Honda T, Domon H et al. Gene expression analysis of the CD4+ T-cel clones derived
lymphocytes and activated B lymphocytes in tissues with periodontal disease. J Periodont from gingival tissues of periodontitis patients. Oral Microbiol Immunol 2005,20:382-386.
58. Okui T, Ito H, Honda T, Amanuma R, Yoshie H, Yamazaki K. Characterization of CD4+
24. Reinhardt RA, Bolton RW, McDonald TL, DuBois LM, Kaldahl WB. IgG subclasses in gingi-
Foxp3+ T-cell clones established from chronic inflammatory lesions. Oral Microbiol Immunol
val crevicular fluid from active versus stable periodontal sites. J Periodontol 1989,60:44-50.
25. Seymour GJ, Gemmel , Reinhardt RA, Eastcot J, Taubman MA. Immunopathogenesis
of chronic inflammatory periodontal disease: cellular and molecular mechanisms. J Peri-
odont Res 1993,28:478-486.
26. Ebersole JL, Taubman MA. The protective nature of host responses in periodontal dis-
eases. Periodontol 2000 1994,5:112-141.
27. Salvi GE, Beck JD, Of enbacher S. PGE2, IL-1B and TNF-a responses in diabetics as
modifiers of periodontal disease expression. Ann Periodontol 1998,3:40-50.
28. Cua DJ, Sherlock J, Chen Y et al. Interleukin-23 rather than interleukin-12 is the critical
cytokine for autoimmune inflammation of the brain. Nature 2003,421:744-748.
29. Langrish CL, Chen Y, Blumenschein WM et al. IL-23 drives a pathogenic T cell popula-
Andrea Dezerega Piwonka
tion that induces autoimmune inflammation. J Exp Med 2005,201:233-240.
Laboratorio de Biología Periodontal, Departamento de Odontología
30. Kastelein RA, Hunter CA, Cua DJ. Discovery and biology of IL-23 and IL-27: related but Conservadora, Facultad de Odontología, Universidad de Chile. Chile.
functionally distinct regulators of inflammation. Annu Rev Immunol 2007,25:221-242.
Olivos 943, Independencia. Santiago – Chile.
31. Weaver CT, Hat on RD, Mangan PR, Har ington LE. IL-17 family cytokines and the
expanding diversity of effector T cell lineages. Annu Rev Immunol 2007,25:821-852.
Fono: 56 2 978 18 33
32. Glimcher LH, Murphy KM. Lineage commitment in the immune system: the T helper Fax: 56 2 978 18 39
lymphocyte grows up. Genes Dev 2000,14:1693-1711.
33. Ivanov I , McKenzie BS, Zhou L et al. The orphan nuclear receptor RORyt directs the
differentiation program of proinflammatory IL-17+ T helper cells. Cell 2006,126:1121-1133.
34. Betteli E, Carrier Y, Gao W et al. Reciprocal development pathways for the generation of
pathogenic effector TH17 and regulatory T cells. Nature 2006,441:235-238.
35. Korn T, Betteli E, Gao W, et al. IL-21 initiates an alternative pathway to induce proinflam-
Trabajo recibido el 30/06/2008.
matory T(H)17 cells. Nature 2007,448:484-487.
Aprobado para su publicación el 09/07/2008.
Source: http://sioch.cl/piro/Revista-PIRO_V-1-N-2.pdf
DOI: 10.7574/cjicl.02.03.118Cambridge Journal of International and Comparative Law (2)3: 640–656 (2013) Abortion and a Right to Health inInternational Law: L.C. v PeruCharlotte Bate Abortion, international law, Latin America, reproductive rights, CEDAW, Peru In November 2011, the Committee on the Elimination of Discrimination AgainstWomen decided a complaint originating from Peru. The complaint concerned ayoung woman, L.C., who was denied access to a safe and legal abortion that sherequired so that she could undergo urgent medical treatment. This article wiladdress the decision, its place in international human rights law, and its likelyimpact, if any, on abortion legislation in Peru.
Pediatric Depression in Primary Care: Assessment and Management Epidemiology. Depression is surprisingly common in the pediatric population, and the risk of depression increases with age into adolescence and young adulthood. Major depressive disorder (MDD) affects approximately 3% of prepubertal children and 4 to 8% of adolescents at any one time. Prepubertal girls and boys are affected equally, but female








