exposÈ
Iontophorese mit Voltaren® Emulgel® als eine
mögliche physiotherapeutische
Behandlungsmethode bei Schmerzzuständen
Erläuterung am Beispiel von postoperativen Schmerzen
nach einer mikrochirurgischen Bandscheibenoperation
in der Lendenwirbelsäule
Wissenschaftliche Hausarbeit zur Erlangung
des akademischen Grades einer Magistra Artium
der Universität Göttingen
Franziska Fincke
23. Januar 2002
In diesem Verzeichnis sind alle in der Arbeit vorkommenden Fachausdrücke aufgeführt, für die in der Literatur in der Regel Abkürzungen verwendet werden. Bei der jeweils ersten Nennung im Text ist die vollständige Bezeichnung genannt, danach wird die Abkürzung verwendet. Allgemein gebräuchliche, im Duden der deutschen Sprache verwendete Abkürzungen, sind in diesem Verzeichnis nicht erwähnt. C
International Association for the Study
McGill Pain Questionnaire
nichtsteroidale
OP Operation PC „Pacinian
PG Prostaglandin(e) PHS
Periarthropatia
Humeroscapularis
Rr Rami SA „slowly
Zentralnervensystem
1. Einleitung
Der Schmerz nach einer Bandscheibenoperation ist nicht nur Folge
der Operation und der Wundheilung. Gerade durch einen Bandscheibenvorfall werden so viele Strukturen des
operativen Beseitigung des vorgefallenen Bandscheibengewebes eine komplexe Schmerzsymptomatik fortbestehen kann.
Schmerzlindernde Medikamente wie Voltaren®, ein nichtsteroidales
Antiphlogistikum (NSA) mit dem Wirkstoff Diclofenac, werden in
der Regel oral verabreicht. Sie rufen aber unerwünschte Nebenwirkungen hervor: Das Spektrum reicht von einer leichten
Irritation der Magen- und Darmschleimhaut bis zu deren völligen Zerstörung nach einer Langzeittherapie (vgl. Jurna 1992, 219).
Diese Nebenwirkungen könnten durch eine lokale Therapie direkt
am Entstehungsort des Schmerzes verringert werden. Zu einer solchen lokalen Therapie gehört die Iontophorese. Bei dieser
pharmako-physikalischen Maßnahme gelangt der Wirkstoff, der in einer Salbe enthalten ist (Voltaren® Emulgel® mit dem Wirkstoff
Diclofenac-Diethylaminsalz), die auf der Haut eingerieben wird,
mittels des über Plattenelektroden applizierten galvanischen Stromes in die Haut und darunterliegende Gewebeschichten.
1 Das Bewegungssegment ist die Bau- und Funktionseinheit der
Wirbelsäule. Es wird gebildet von der Bandscheibe, den Hälften der benachbarten Wirbelkörper mit ihrer Grund- bzw. Deckplatte, den Wirbelgelenken und den Quer- und Dornfortsätzen, den Ligamenta (Ligg.) flava und interspinalia, den auf dieser Höhe befindlichen Abschnitten des hinteren und vorderen Längsbandes und Ligamentum (Lig.) supraspinale,
den entsprechenden Weichteilen und dem Foramen intervertebrale mit dem austretenden Nerv und seinen Versorgungsgebieten: Hautareale, Muskeln, Knochen und Gelenke, innere Organe, Gefäße, Schweißdrüsen, Piloarrektoren.
Es stellt sich jedoch die Frage, ob, und wenn ja, welche an der
Schmerzentstehung beteiligten Strukturen durch den Wirkstoff oder den elektrischen Strom erreicht werden können, so daß ein
schmerzlindernder Effekt eintritt.
Somit bedarf die therapeutische Anwendung der Iontophorese zur
postoperativen Schmerzlinderung eines empirischen Nachweises. Denn bisher wurden nach dem Kenntnisstand der Verfasserin noch
keine klinischen Studien über die analgetische Wirksamkeit der Iontophorese mit schmerzlindernden Medikamenten bei
postoperativen Schmerzzuständen durchgeführt.
Es liegen allerdings Untersuchungen zur Wirksamkeit bei anderen
Erkrankungen des Bewegungsapparates von Demirtas/Öner (1998), Vecchini/Grossi (1984) und Pavelka et al. (1988) vor.
Diese Studien führten jedoch zu widersprüchlichen Ergebnissen und
weisen solche Mängel auf, daß ihre Aussagekraft in Frage gestellt werden muß. Des weiteren sind sie aufgrund der uneinheitlichen
Krankheitsbilder und Anwendungsformen der Iontophorese nur unzulänglich vergleichbar.
Zum jetzigen Zeitpunkt ist also noch unklar, ob eine Iontophorese mit Diclofenac Schmerzen nach einer mikrochirurgischen
Bandscheibenoperation lindert bzw. in einem größeren Ausmaß lindert als eine Anwendung mit Plazebo und Strom, Plazebo und
Scheinstrom oder Voltaren® Emulgel® und Scheinstrom.
Eine Studie, die diese Frage beantworten soll, muß – das zeigen die
Mängel der vorliegenden Untersuchungen – gewissen Mindestansprüchen genügen. Deshalb soll in dieser Arbeit eine
solche Studie geplant werden.
Bei der Planung sollen bisherige Erkenntnisse bezüglich der
Tiefenpenetration und pharmazeutischen Wirksamkeit des Wirkstoffes Diclofenac berücksichtigt werden. Außerdem werden
Überlegungen einfließen, wie die Wirksamkeit der Iontophorese verbessert werden kann.
Schließlich sollen klinische Meßverfahren für den Nachweis einer analgetischen aber auch antiphlogistischen Wirkung der
Therapieform vorgestellt werden.
Der Anwendung nichtsteroidaler Antirheumatika nach einer
Operation steht der Verdacht entgegen, daß aufgrund ihrer antiphlogistischen Wirkung eine negative Beeinflussung der
entzündlichen Phase der Wundheilung, die in den ersten drei Tagen nach der Operation stattfindet, erwartet werden könnte (vgl.
Sedlarik 1993, 149). Dies muß im Rahmen dieser Examensarbeit
genauer untersucht werden, weil die Bestätigung dieser Aussage eine Einschränkung für die Anwendung des Medikamentes in dieser
Applikationsform darstellen würde.
Um das komplexe Schmerzgeschehen nach einer
Bandscheibenoperation und die mögliche schmerzlindernde Wirkung lokaler, über die Haut verabreichter medikamentöser oder
elektro-medikamentöser Therapieformen besser verstehen zu können, erfolgt zu Beginn der Arbeit eine Darstellung aller
möglichen an der postoperativen Schmerzentstehung beteiligten
Strukturen des Bewegungssegmentes.
2. Bandscheibendegeneration in der Lendenwirbelsäule
2.1. Anatomische, physiologische und pathophysiologische
Grundlagen
Bandscheibenbedingte Erkrankungen in der Lendenwirbelsäule
treten am häufigsten zwischen dem vierten und fünften Lendenwirbel und fünften Lenden- und ersten Sacralwirbel auf (vgl.
Grubel/Schröder 1999, 533).
An der Entstehung solcher Erkrankungen ist nicht allein die
Bandscheibe beteiligt. Auch benachbarte und funktionell mit der
Bandscheibe in enger Beziehung stehende Strukturen des Bewegungssegmentes spielen eine entscheidende Rolle.
Die Bandscheibe besteht aus einem äußeren, straffen Anulus
fibrosus und aus einem weichen, gallertartigen Kern, Nucleus
pulposus. Der Anulus fibrosus ist aus konzentrisch angeordneten kollagenen Fasern und Faserknorpel aufgebaut, wodurch der
Nucleus pulposus in Spannung gehalten wird (vgl. Platzer 1991, 54).
Die Bandscheibe steht anatomisch und funktionell in enger
Beziehung zu den knorpeligen Grund- und Deckplatten und bildet mit diesen den Zwischenwirbelabschnitt.
Für das Auftreten von Bandscheibenvorfällen ist es wichtig zu
erwähnen, daß das hintere Längsband (Lig. longitudinale posterius)
im Bereich der Lendenwirbelsäule die hintere Bandscheibenbegrenzung nicht ganz abdeckt, sondern die dorso-
lateralen Abschnitte frei läßt, jene Abschnitte, an denen Bandscheibenvorfälle am häufigsten auftreten (vgl. Putz 1985,
Die Hauptursachen der allgemeinen Bandscheibendegeneration
liegen beim Menschen in der frühzeitigen Alterung bradytropher Gewebe und in der evolutionsbedingten Aufrichtung, die zu einer
axialen Belastung der Wirbelsäule führte (vgl. Krämer 1995, 635). Hinzu treten noch unterschiedliche anlagebedingte Faktoren (u.a.
Ernährungszustand und Anpassungsfähigkeit des Gewebes) und
Risikofaktoren (u.a. Rauchen), die die Degeneration beschleunigen können.
Ursprünglich stellen die Zwischenwirbelabschnitte des Menschen
kein bradytrophes Gewebe dar: Im Säuglingsalter ist das
Bandscheibengewebe vaskularisiert (vgl. v. d. Berg 1994, 7). Infolge der Aufrichtung kommt es jedoch durch den
Belastungsdruck (Summe aus Oberkörpergewicht und Muskeltonus) zu hohen Drücken im Bandscheibengewebe und auf die dort
befindlichen Gefäßwände. Da der hydrostatische Druck größer ist
als der Venen- und Arteriolendruck, kann keine Filtration mehr in das Gewebe stattfinden und die Gefäße gehen infolge einer
Druckatrophie zugrunde (vgl. Krämer 1994, 47). Dadurch ändert sich das Versorgungsprinzip der Bandscheibe: Der
Stoffaustausch findet nun durch Diffusion statt, die der normalen
Blutversorgung weit unterlegen ist (vgl. Töndury 1958, 71; Holm 1993, 13):
„.the main mechanism of metabolite transport is diffusion, and
the main route of nutrient supply into the nucleus is via the
endplate." (Holm et al. 1981, 101)
Der Transport von Nährstoffen in den Nucleus pulposus und den inneren Anteil des Anulus fibrosus erfolgt über die Endplatten der
Wirbelkörper, die die Eigenschaften einer semipermeablen
Membran besitzen (vgl. Holm et al. 1981, 112). Die im Nucleus
pulposus befindlichen Makromoleküle (hauptsächlich Polysaccharide) weisen eine sehr hohe Wasseranziehungskraft auf
(osmotischer Druck) und können dadurch Flüssigkeiten auch bei hoher Druckbelastung halten oder aufnehmen. Das Verhältnis
zwischen hydrostatischem und osmotischem Druck bestimmt den
Flüssigkeitsstrom und damit den Ernährungszustand der Bandscheibe. Das heißt, daß für eine möglichst gute Versorgung
ein Wechsel von Druckbelastung und Entlastung notwendig ist. Aufrechte Haltung und mangelnde Anpassungsfähigkeit der
Bandscheibenzellen an die veränderte Versorgungslage haben beim
Menschen zur Folge, daß das Binde- und Stützgewebe eine minderwertige Qualität aufweist, was frühzeitig zu Verschleiß führt,
„Die aktiven und passiven Transportmechanismen an der
Bandscheibengrenze sind bei den meisten Menschen nicht in der Lage, über Jahrzehnte eine konstante Versorgung der
Bandscheibenzellen zu gewährleisten." (Krämer 1994, 48)
Bewegungsarmut und konstante Haltung in gleichbleibender
Position unterstützen die schlechte Versorgungslage der Bandscheibe, weil der Stoffaustausch an den Übergängen zu den
Grund- und Deckplatten durch den fehlenden Wechsel von Be- und Entlastung nicht mehr gewährleistet ist.
Durch die schlechten nutritiven Bedingungen ändert sich sowohl die chemische Zusammensetzung als auch die anatomische Struktur
des Zwischenwirbelabschnittes: Die Zellen der Bandscheibe (Fibroblasten) bilden aufgrund des Mangels an Substraten und
Energie Fasern und Grundsubstanz in unzureichender Qualität und
gehen schließlich selbst zugrunde (vgl. Krämer 1994, 48). Darüber hinaus kann der Nucleus pulposus im Alter durch
Dehydration schrumpfen, wodurch sich ein Hohlraum bildet. Dadurch werden die Fasern des Anulus fibrosus nicht mehr unter
Spannung gehalten und es kann zu Einrissen einzelner
Faserlamellen kommen. Die Fissuren verlaufen entweder in konzentrischer, häufiger jedoch
in radiärer Richtung (vgl. Kapandji 1992, 114). Solange die Druckkraft des Nucleus pulposus groß genug ist, können unter
Bewegung (vor allem Flexion in der Lendenwirbelsäule in
Kombination mit einer Rotation) und Einwirkung axialer Druckkräfte Teile des Gallertkerns - dem Druck ausweichend - in
die radiären Spalten eindringen. Die Substanzverlagerung erfolgt in der Regel entsprechend des
Belastungsmechanismus in dorsale oder dorsolaterale Richtung,
was durch die fehlende ligamentäre Begrenzung in diesem Bereich begünstigt wird.
Bleiben der äußere Rand des Anulus fibrosus und das hintere Längsband intakt, handelt es sich um eine
Bandscheibenvorwölbung oder Protrusion (vgl. Debrunner 1995,
658). Diese stellt in der Regel keine Operationsindikation dar. Ein Bandscheibenvorfall oder Prolaps liegt vor, wenn Anulus
fibrosus und hinteres Längsband rupturieren und Bandscheibengewebe in den Spinalkanal vordringt (vgl. ebenda).
Bei einem Bandscheibensequester handelt es sich um einen vom
„gesunden" bzw. lebenden Bandscheibengewebe isolierten, abgestorbenen Teil, der frei im Spinalkanal liegt, aber dort auch
seine Lage verändern kann.
In dem prolabierten Gewebe befinden sich Teile des Gallertkerns
und Faserringes, aber auch Knorpelbestandteile aus den Grund- und Deckplatten (vgl. Krämer 1994, 50).
Die Einbrüche und Risse in den Grund- und Deckplatten bewirken,
daß von der Spongiosa der Wirbelkörper eine Vaskularisierung des
Zwischenwirbelraumes ausgeht. Dadurch kommt es zur Verdrängung des noch vorhandenen Bandscheibengewebes und zur
Bildung eines lockeren zell- und gefäßreichen Narbengewebes (vgl. ebenda).
Die Volumen- und Höhenänderungen im Zwischenwirbelabschnitt führen weiterhin zu Stellungsänderungen der Wirbelgelenke. Eine
Abnahme der Höhe bewirkt eine vermehrte Konvergenzstellung der Wirbelgelenke, wodurch die Knorpelflächen vermehrtem Druck
ausgesetzt sind. Die Folge ist Knorpelabrieb und Arthrose der
Eine weitere Komplikation stellt die Instabilität des Segmentes dar, weil durch die Höhenabnahme die Bänder an Spannung verlieren.
Diese Instabilität kann zu Blockierungen der Facettengelenke
Es ist festzuhalten, daß die Degeneration ein alterungsbedingtes, mehr oder weniger physiologisches Nachlassen der Gewebequalität
darstellt, die hauptsächlich im jungen und mittleren Lebensalter
stattfindet und zu klinischer Bedeutung gelangen kann, wenn Nerven und andere Strukturen durch diese Vorgänge beeinträchtigt
werden und Schmerzen oder neurologische Störungen auftreten.
3. Die Therapie der Bandscheibenerkrankungen
Die Therapie von Bandscheibenvorwölbungen und -vorfällen hat in
erster Linie das Ziel, Schmerzen zu lindern oder Lähmungen zu beheben.
Sie erfolgt in der Regel zunächst konservativ und umfaßt unter
anderem Bettruhe, medikamentöse Behandlung, physikalische Therapie, Physiotherapie, Akupunktur oder Injektionen (vgl.
Postacchini et al. 1998, 342, 344, 345, 353).
Eine Bandscheibenoperation ist indiziert, wenn ein beginnendes
Kaudasyndrom mit Reithosenanästhesie und Blasen- oder Mastdarmstörungen vorliegt. Erfolgt der operative Eingriff nicht
innerhalb kürzester Zeit nach Einsetzen der Störungen, muß mit dauerhaften Funktionsstörungen gerechnet werden.
Ebenso erfordern akute Lähmungen funktionell wichtiger Muskeln
wie des M. tibialis anterior, M. extensor hallucis oder M. quadriceps einen sofortigen Eingriff.
Führt eine konsequente konservative Behandlung über vier bis
sechs Wochen nicht zu einer Linderung der Beschwerden und
bleiben vor allem starke Schmerzen bestehen, muß eine Operation in Betracht gezogen werden.
Es bleibt jedoch zu berücksichtigen, daß sich
„.selbst schwere Nervenwurzelkompressionserscheinungen unter
adäquater konservativer Behandlung innerhalb kurzer Zeit zurückbilden." (Krämer 1994, 280)
3.1. Die Bandscheibenoperation in der Lendenwirbelsäule
Eine Bandscheibenoperation hat das Ziel, verlagertes
Bandscheibengewebe zu entfernen und die Nervenwurzel zu entlasten.
3.1.1. Operationstechnik
Bei der im hier beschriebenen Operationstechnik handelt es sich
um ein standardisiertes Verfahren, das aber von jedem einzelnen
Operateur in Abhängigkeit von dem vorliegenden Befund verändert oder erweitert werden kann (vgl. Weber 1993, 287).
Der Patient wird für die Operation üblicherweise mit dem Bauch auf
einem speziellen Rahmen oder in Kniehocklage gelagert, so daß die
Lendenwirbelsäule kyphosiert ist und die Operation von dorsal aus erfolgen kann (vgl. derselbe 288, Krämer 1994, 283).
Der Zugang bis zum Lig. flavum bzw. bis zum Spinalkanal wird makrochirurgisch durchgeführt, der weitere Vorgang
mikrochirurgisch mit Vergrößerungstechnik (vgl. Weber 1993,
287). Der Hautschnitt erfolgt über den Dornfortsätzen der
Lendenwirbelsäule oder in einem Zentimeter Entfernung daneben (paramedian) auf der Seite des Vorfalls durch die Epidermis,
Dermis und Subcutis in Längsrichtung. Die Länge beträgt ungefähr
drei bis fünf Zentimeter (vgl. Weber 1993, 289; Papavero/Caspar 1993, 34).
Die Fascia thoracolumbalis wird inzisiert. Um die Muskulatur aus dem Sichtfeld halten zu können, wird sie
mit einem spezifischen Operationsinstrument beiseite geschoben.
Die Muskelansätze an den Dornfortsätzen können zusätzlich scharf
eingekerbt werden (vgl. Weber 1993, 292). Anschließend wird das Lig. flavum freigelegt und reseziert (vgl. Papavero/Caspar 1993,
34). Bei einigen Patienten ist es nötig, Teile des Wirbelbogens oder
diesen auf einer Seite ganz zu entfernen, damit die Nervenwurzel
und der Prolaps besser sichtbar gemacht werden können (vgl. Krämer 1994, 283).
Erreicht der Operateur den Spinalkanal, kann ein freier Sequester vorsichtig mobilisiert und teilentfernt werden. Liegt kein Sequester
vor, wird die Nervenwurzel über die Kuppe des Prolapses beiseite
geschoben. Das Lig. longitudinale posterius wird inzisiert und hervorquellendes Bandscheibengewebe kann ausgeräumt werden
(vgl. Weber 1993, 296). Anschließend wird der Zugang zum Bandscheibenraum ganz
freigelegt und eingesehen. Im Wirbelkanal befindliche Sequester
können während der Operation durch Epiduroskopie ausgemacht und schließlich entnommen werden (vgl. Krämer 1994, 283).
Zusätzlich wird noch restliches mobiles Bandscheibengewebe aus dem Bandscheibenfach beseitigt, um einem Rezidiv vorzubeugen.
Während der Operation erfolgt bei kleinen Gefäßen und Kapillaren
eine natürliche Mikrothrombose, die zum Gefäßverschluß führt (vgl. Sedlarik/Klöcking 1993, 62).
Größere Gefäße werden durch die Anwendung folgender Mechanismen verschlossen:
mechanischer Druck
Elektrokauterisation
Abklemmen und Ligaturen
örtlich wirkende Hämostatika (vgl. derselbe 61).
Die Schnittwunden der einzelnen Gewebe (Haut, Faszie, Bänder)
werden nach der Operation durch eine Naht verschlossen. Für den Sekretabfluß aus dem Operationsgebiet wird eine Redondrainage
gelegt (vgl. Wegner-Kempf 1988, 13). Den entstandenen Defekt in der Bandscheibe füllen Blut und
3.1.2. Postoperative Wundheilung
Die Wundränder der Haut und darunterliegender Gewebe sind nach
der Operation glatt und liegen durch die Naht dicht beieinander, so daß eine primäre Wundheilung stattfinden kann (vgl. Irvin 1990,
3). Es entsteht nur wenig Granulationsgewebe.
Bei dem Prozeß der Blutstillung in den Gefäßen und dem
unmittelbaren Verschluß der Wunde durch ein Fibringerinnsel
wirken das Thrombozyten-, das Gefäßsystem und das Gerinnungssystem mit (vgl. Sedlarik/Klöcking 1993, 61).
Die Wundheilung läßt sich künstlich in drei Phasen einteilen.
Die erste Phase beginnt mit der Wundsetzung durch den Schnitt
und dauert ungefähr drei Tage (vgl. Winkeltau/Schumpelick 1999, 43). Der Verletzung folgt der Austritt von Blut und Blutplasma in
den Gewebedefekt (Exsudation). Es kommt durch die Aktivierung der Blutgerinnung zur Bildung eines Fibrinkoagulums, bestehend
aus Fibrin, Erythrozyten und Granulozyten (vgl. Sedlarik/Audring
1993, 70).
Innerhalb der Blutgefäße wird die Blutstillung durch
Thrombozytenaggregation und Thrombozytenadhäsion sowie die Ausschüttung vasoaktiver und chemotaktischer Substanzen
herbeigeführt (vgl. Winkeltau/Schumpelick 1999, 44).
Schon nach wenigen Stunden wandern Granulozyten, Monozyten
und Histiozyten in die Wunde. Es kommt zur Aktivierung der Fibrinolyse. Das Fibringerinnsel und nekrotisches Gewebe werden
phagozytiert und durch lysosomale Enzyme abgebaut. Dieser Abbauprozeß erfolgt durch das aktivierte körpereigene Enzym
Plasmin (vgl. Sedlarik/Klöcking 1993, 65).
Die zweite Phase beginnt um den 4. Tag (vgl.
Winkeltau/Schumpelick 1999, 45). Kapillaren sprießen vom Wundrand aus in die Wunde. Fibroblasten
beginnen, Glykoproteine, Proteoglykane und Kollagenfibrillen zu
synthetisieren, die die Interzellularsubstanz bilden (Proliferation). Es entsteht schließlich ein junges, stark kapillarisiertes
Bindegewebe, das vom Rand her in die Mitte des Defekts vorwächst und diesen bald vollständig ausfüllt (vgl. ebenda).
Der Übergang zur dritten Phase erfolgt um den 21. Tag (vgl. McLatchie 2000, 48).
Zu Beginn dieser Phase nimmt die Zahl der Fibroblasten ab. Die neuen Kapillaren werden verschlossen und gehen zugrunde (vgl.
Irvin 1990, 12).
Die bleibende Narbe ist gefäßfrei und besitzt Kollagenfasern, die sich entlang der Spannungslinien der Haut ausrichten (vgl.
3.1.2.1. Biochemie der Wundheilung
Der normale Vorgang der Wundheilung wird von einem komplexen System von chemischen, zellulären und physikalischen Faktoren
gesteuert.
Die infolge der Gewebeverletzung stattfindende Gefäßdilatation in
der ersten Phase wird durch die lokale Freigabe von Histamin aus Gewebemastzellen, basophilen Granulozyten und Thrombozyten
verursacht (vgl. Irvin 1990, 13). Histamin läßt sich in hoher Konzentration kurz nach der Wundsetzung im Wundsekret und im
Blut nachweisen (vgl. ebenda). Die Wirkungsdauer ist kurz und
beträgt in etwa 30 Minuten (vgl. Sedlarik/Audring 1993, 73). Im weiteren Verlauf finden sich Serotonin und andere im Blut
zirkulierende Wirkstoffe, die eine Vasodilatation und Erhöhung der Gefäßpermeabilität hervorrufen. Histamin und Serotonin greifen
nicht an den Kapillaren, sondern an Gefäßen mit einem Durchmesser von 20 bis 30µm im Bereich des venösen Schenkels
an, in die das kapilläre Blut abgeleitet wird (vgl. Sedlarik/Audring
1993, 73). Weitere wichtige Substanzen sind die Kinine Bradykinin und
Kallidin. Ihre Synthese erfolgt im Blutplasma, wenn Blut oder
andere Gewebe einem Trauma ausgesetzt werden. Granulozyten transportieren sie in das traumatisierte Gebiet. Bradykinin erweitert
die Gefäße außerordentlich stark und ermöglicht damit die Verbesserung der Mikrozirkulation im Wundgebiet (vgl. derselbe
Schließlich sind noch verschiedene Prostaglandine
(Gewebshormone) an der ersten Phase der Wundheilung beteiligt. Prostaglandine (PG) werden in den verschiedensten
Körpergeweben aus Arachidonsäure gebildet. Sie verursachen die
schmerzauslösende Wirkung von Bradykinin, Histamin und weiteren durch die operative Gewebeverletzung freigesetzten Substanzen
(vgl. Riede 1995, 210).
1 tion hervor und senkt dadurch
den peripheren Gefäßwiderstand. Dieses Prostaglandin hat jedoch keinen Effekt auf die Gefäßpermeabilität. Es verstärkt aber die
Wirkung anderer Mediatoren wie Histamin oder Bradykinin und trägt damit zur Ödementstehung bei (vgl. Giertz et al. 1992, 323).
PGI2 verhindert die Aggregation und Adhärenz der durch Thromboxan aggregierenden Thrombozyten am Endothel. (vgl. Giertz et al. 1996, 338).
Thromboxan (TX), ein weiterer Metabolit der Arachidonsäure,
fördert die Thrombozytenaggregation, die für einen primären
Verschluß verletzter Gefäße bedeutsam ist (vgl. Giertz et al. 1996, 338).
Der Wirkstoff Diclofenac hemmt die Biosynthese dieser
Prostaglandine. Dadurch werden auf der einen Seite die
exsudativen und proliferativen Vorgänge verringert. Andererseits wird die schmerzauslösende Wirkung der anderen algetisch
wirksamen Substanzen herabgesetzt.
2 Die Buchstabenbezeichnungen kennzeichnen die Substitutionen an der Cyclopentanringstruktur des Prostaglandinmoleküls. Die Zahlen im Index stehen für die Anzahl der Doppelbindungen in der Carboxyl- bzw. Alkylseitenkette (vgl. Giertz et al. 1996, 321, 339).
4. Der Schmerz nach einer Bandscheibenoperation
4.1. Allgemeine Grundlagen der Schmerzphysiologie
Der Schmerz informiert den Menschen über eine endo- oder
exogene Bedrohung des Organismus und bewahrt ihn vor
dauerndem Schaden. Nach Auffassung einer internationalen Expertenkommision (International Association for the Study of
Pain, IASP) ist Schmerz
„an unpleasant sensory and emotional experience associated with
actual or potential tissue damage, or described in terms of such damage " (IASP 1979, 250)
Schmerz ist also mehr als eine Sinnesempfindung, die durch
Erregung der Schmerzrezeptoren hervorgerufen wird. Durch den
Einfluß der affektiven Komponente kann der Schmerz zu einem unlustbetonten Sinnes- und Gefühlserlebnis werden (vgl.
Schmidt/Schaible 2000, 236). Ursache der Schmerzempfindung, so wird in der Definition
festgehalten, ist eine tatsächliche oder potentielle
, also noch nicht
eingetretene Gewebeschädigung. Das heißt, für das Schmerzerlebnis ist es unwichtig, ob eine Schädigung tatsächlich
stattgefunden hat.
Im Zusammenhang mit der Physiologie des Schmerzes ist es
notwendig, die Begriffe Nozizeption und Schmerz zu trennen und zu definieren.
Als Nozizeption wird die Aufnahme, Weiterleitung und zentralnervöse Verarbeitung noxischer Reize verstanden.
Von diesen neurophysiologischen Vorgängen ist die „subjektive"
Empfindung Schmerz oder das Schmerzerlebnis deutlich abzugrenzen (vgl. Schmidt/Schaible 2000, 240).
Heute ist davon auszugehen, daß der Schmerz eine eigenständige
Empfindung mit spezifischen Schmerzrezeptoren (Nozizeptoren),
Leitungsbahnen und Verarbeitungszentren ist (vgl. ebenda).
4.1.1. Schmerzentstehung in einem Bewegungssegment
Wie in der Einleitung bereits gesagt wurde, gehören zu einem Bewegungssegment neben den um die Bandscheibe angeordneten
Strukturen, die das Vertebron bilden, das Versorgungsgebiet des Spinalnerven: das innervierte Hautareal (Dermatom), die
innervierte Muskulatur (Myotom), das innere Organ (Enterotom),
der Knochen (Sklerotom) und die Gefäße, Schweißdrüsen und Piloarrektoren.
Der Spinalnerv ist ungefähr ein Zentimeter lang und entsteht durch
die Vereinigung der sensiblen hinteren Wurzel und der motorischen
vorderen Wurzel, die die das Rückenmark verlassenden Nervenfasern enthalten (vgl. Zenker 1985, 108). Unmittelbar
proximal von der Vereinigungsstelle ist in jede hintere Wurzel ein Spinalganglion
Dieser Spinalnerv teilt sich kurz nach seinem Austritt aus dem
Foramen intervertebrale in einen Ramus (R.) ventralis, einen R.
3 Spinalganglien sind Ansammlungen von Zellkörper bi- und multipolarer (sympathischer und parasympathischer) oder pseudounipolarer Nervenzellen (Nozizeptoren) (vgl. Hoffmann La Roche AG & Urban und Schwarzenberg 1999, 601).
dorsalis, R. meningeus und einen R. communicans (vgl. Kahle
1991, 64). Der R. ventralis versorgt die zu dem entsprechenden
Rückenmarkssegment gehörende autochthone Muskulatur der Rumpfvorderwand und Seitenwand sowie die quergestreifte
Muskulatur der Extremitäten, das Myotom
innerviert er sensibel die entsprechenden Hautareale, das Dermatom (vgl. Kahle 1991, 64). Der R. dorsalis gibt Zweige an die
Facettengelenke und die Kapsel ab, innerviert sensibel die Hautregion beiderseits der Wirbelsäule und motorisch die
autochthone Rückenmuskulatur (vgl. Brokmeier 1996, 131, Krämer
Der R. meningeus innerviert nach dem Wiedereintritt in den Wirbelkanal die inneren Anteile der Kapsel der Facettengelenke,
das Periost des Wirbelkörpers, das hintere und vordere Längsband,
den äußeren Rand des Anulus fibrosus der Bandscheibe und die Rückenmarkshäute (vgl. Brokmeier 1996, 132).
Der R. communicans verläuft als präganglionärer R. communicans albus zum sympathischen Grenzstrangganglionhrt nach
Umschaltung als postganglionärer R. communicans griseus zum
Spinalnerven zurück.
4 Die Ordnung der Muskulatur der Extremitäten ist nicht segmental, weil
die Rr. ventrales der Spinalnerven hier Nervengeflechte (Plexi) bilden und es dadurch zu einem Austausch von Fasern kommt. Die neu gebildeten Nervenstämme, die dann in die Peripherie ziehen, weisen einen neu geordneten Faserbestand auf und versorgen verschieden Muskeln (vgl. Kahle 1991, 64).
5 Der Grenzstang erstreckt sich zu beiden Seiten der Wirbelsäule von der Schädelbasis bis zur Steißbeinspitze und wird gebildet von den einzelnen Ganglien des Sympathikus, die durch kurze Rami miteinander verbunden sind (vgl. Zetkin/Schaldach 1992, 2158).
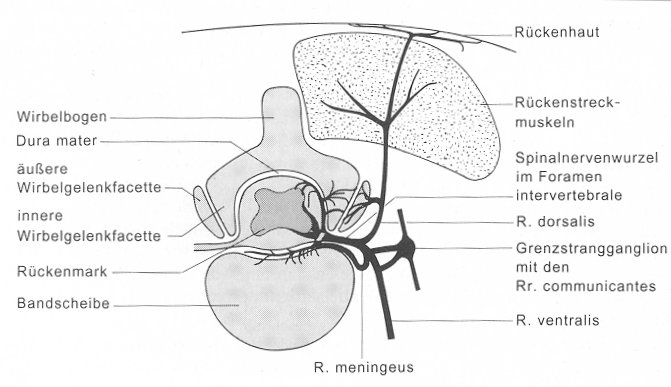
Abb. 1. Versorgungsgebiete der einzelnen Rami eines Spinalnerven
(Krämer 1994, 64)
Das zu einem Vertebron gehörende Rückenmarkssegment ist
Umschaltstelle für die von zentral absteigenden motorischen
Bahnen und – unter anderem im Bereich der oberen Lendenwirbelsäule - Ursprungsort der präganglionären Fasern
sympathischer Neurone (vgl. Kahle 1991, 272; Brokmeier 1996, 139).
Es ist darüber hinaus die Sammelstelle aller sensiblen
Informationseingänge: Alle Erregungen aus dem Vertebron selbst, aus dem Dermatom, Sklerotom, Enterotom und dem vegetativen
Versorgungsgebiet gelangen über die hintere Wurzel in das Rückenmark (vgl. Brokmeier 1996, 131).
Ein Teil dieser afferenten Zuflüsse kommt von den
Schmerzrezeptoren, die sich in fast allen Geweben und Organen des menschlichen Organismus befinden.
Die nozizeptive Versorgung der einzelnen Teile des
Bewegungssegmentes selbst ist sehr variabel: eine reichliche
Versorgung weist das hintere Längsband, eine etwas geringere das vordere Längsband und der äußere Bereich des Anulus fibrosus auf
(vgl. Konttinen 1990, 383). Neue Studien zeigen, daß sich Nozizeptoren auch in den Grund- und Deckplatten und den
angrenzenden Knochenabschnitten der Wirbelkörper befinden (vgl.
Brown et al. 1997, 147). Der Nucleus pulposus der Bandscheibe wird nicht von Nozizeptoren versorgt (vgl. v. d. Berg 1994, 7).
Der Schmerz im Bereich des Bewegungssegmentes kann nach einer
Bandscheibenoperation also von folgenden Strukturen seinen
Ursprung nehmen:
1. Von der Haut, den Faszien und Gefäßen, die durch den
chirurgischen Schnitt verletzt und zum Teil wieder genäht
2. Von der Nervenwurzel in Form eines projizierten Schmerzes
Auch wenn das prolabierte Bandscheibengewebe durch die Operation entfernt worden ist, können noch
Entzündungsvorgänge an der Nervenwurzel für einige Zeit
weiter bestehen bleiben.
6 Beim projizierten Schmerz ist der Ort der Einwirkung des Schmerzreizes
nicht identisch mit dem Ort der Schmerzempfindung. Der Schmerz entsteht bei der Reizung eines Nerven oder seiner Wurzel. Er wird jedoch empfunden im Versorgungsgebiet (Dermatom) des Nerven, so als würde eine Reizung der Nozizeptoren dieses Hautareals stattfinden.
Der Nerv kann dadurch in seiner Beweglichkeit eingeschränkt
sein und vor allem durch Bewegungen des Hüftgelenkes oder der Lendenwirbelsäule schmerzhaft gereizt werden. Der
Schmerz ist scharf und konstant, die Schmerzaustrahlung erstreckt sich im Dermatom des betroffenen Segmentes.
Es ist weiterhin möglich, daß die Nervenwurzel infolge der
Höhenminderung im Zwischenwirbelabschnitt und der damit einhergehenden Verengung des Foramen intervertebrale an
ihrer Austrittsstelle irritiert wird. Zusätzlich können die mit den allgemeinen degenerativen
Veränderungen der Wirbelsäule einhergehenden arthrotischen
Veränderungen an den Gelenkflächen der Wirbelgelenke das Foramen einengen.
3. Von den Nozizeptoren des Lig. longitudinale posterius, das durch
den Prolaps möglicherweise gereizt und durch die Inzision
während der Operation verletzt wurde. Die von diesem Band ausgehenden Schmerzen sind dumpf und
schwer lokalisierbar.
4. Vom Periost der Wirbelbogenwurzel, das durch Zug der Ansätze
des hinteren Längsbandes gereizt worden sein kann, wenn praeoperativ vorgewölbtes Bandscheibengewebe eine
Längenänderung hervorgerufen hatte (vgl. Krämer 1996, 249).
5. Von den Grund- und Deckplatten der Wirbelkörper. Die
degenerativen Veränderungen und Einbrüche, die mit einem Bandscheibenvorfall einher gehen, können zu einer Reizung der
dort befindlichen nozizeptiven Strukturen führen.
6. Von den Facettengelenken des Bewegungssegmentes. Die durch
den Bandscheibenvorfall bedingte Höhenminderung im Bewegungssegment führt zu einer erhöhten Druckbelastung der
kleinen Wirbelgelenke. Diese Schmerzen sind nicht dermatombezogen.
7. Von der umliegenden Muskulatur.
Diese kann einerseits noch durch eine Dauerinnervation des R.
dorsalis bei einer Wurzelirritation durch prolabiertes Bandscheibengewebe in ihrem Spannungszustand verändert
sein. Diese Verspannung hält oftmals auch in der postoperativen
Phase an und muß durch medikamentöse oder physikalische Therapie beseitigt werden.
Andererseits können auch bei einer Störung, die von den Facettengelenken ausgeht, Verspannungen in den zum Segment
gehörigen Muskeln auftreten, weil der Muskeltonus zum Teil
über die Propriozeptoren der Gelenkkapseln gesteuert wird.
8. Vom Viszerotom. Lumbale Rückenschmerzen können auch von
dem zu dem Rückenmarkssegment gehörenden Viszerotom
ausgehen. Der Eingeweideschmerz wird – genau wie der
Schmerz aus anderen Geweben – über die hintere Wurzel des entsprechenden Segmentes ins Rückenmark geleitet und
schaltet dort auf die aufsteigende Bahn um (siehe nächster Abschnitt). Da an dieser Stelle auch die sensiblen Fasern der
Hautabschnitte, die von diesem Segment versorgt werden,
umschalten, kann der Schmerz an der Hautoberfläche empfunden werden. Dieser Bereich ist dann sehr berührungs-
und schmerzempfindlich (sogenannte Head'sche Zone). Offensichtlich liegt dies darin begründet, daß die Haut eine weit
größere Innervationsdichte als innere Organe besitzt, so daß
mehr kutane als viscerale Rezeptoren mit zentralen
Übertragungsneuronen verbunden sind, was die Wahrnehmungsfähigkeit für die Oberfläche erhöht (vgl.
Handwerker 1998, 254).
4.1.2. Fortleitung der Nozizeption
Die Nozizeptoren der einzelnen Strukturen werden durch Urnoxen (lat. Noxa = Schaden) erregt, die die normale Gewebefunktion
Diese Urnoxen reizen allerdings in der Regel nicht direkt die Nozizeptoren, sondern setzen zunächst Zell- und
Gewebereaktionen in Gang, an deren Ende die Freisetzung von schmerzauslösenden Substanzen wie Bradykinin oder Histamin
steht, die dann im eigentlichen Sinne - bei einer ein
Rezeptorpotential auslösenden Konzentration - erregend auf die Nozizeptoren einwirken (vgl. Schmidt/Schaible 2000, 240).
Die transformierten Rezeptorpotentiale werden als Aktionspotentiale in Abhängigkeit von der Reizstärke in Richtung
Rückenmark weitergeleitet.
Diese Weiterleitung erfolgt über zwei Typen von Nervenfasern:
dünne markhaltige (Gruppe III- oder Aδ-Fasern) marklose Nervenfasern (Gruppe IV- oder C-Fasern)
7 Eine Urnoxe stellt z.B. die mechanische Irritation der Nervenwurzel durch einen Bandscheibenvorfall oder die Wundsetzung in den einzelnen Geweben durch die Operation dar.
8 Die mittlere Leitungsgeschwindigkeit beträgt 15m/s (vgl. Dudel 2000, 37).
9 Die mittlere Leitungsgeschwindigkeit beträgt 1m/s (vgl. Dudel 2000, 37).
Die Signale gelangen zur Substantia gelatinosa im Hinterhorn des
Rückenmarkes im Eintrittssegment sowie den benachbarten Segmenten, und werden auf die Vorderseitenstrangbahn
übertragen.Die Vorderseitenstrangbahn kreuzt im gleichen Segment auf die
Gegenseite und läuft zur Formatio reticularis und dem Tectum im
Hirnstamm (vgl. Fruhstorfer 1994, 41). Dort werden Neurone aktiviert, die vegetative Funktionen
kontrollieren: Atmung, Herzfrequenz, Blutdruck, Schweißsekretion werden meist im Sinne einer erhöhten sympathischen Aktivität
verändert, die Vigilanz nimmt zu (vgl. Jurna 1992, 200).
Vom Hirnstamm gelangt die Erregung zum Hypothalamus, zu den
medialen Thalamuskernen und dem limbischen System. Hier entsteht wahrscheinlich das affektive Schmerzerleben (vgl.
Fruhstorfer 1994, 41).
Außerdem erreichen die Signale den ventrobasalen Thalamus und
werden zu somatosensorischen Zentren im Gyrus postcentralis der Großhirnrinde, wo die kognitive Wahrnehmung des Schmerzes
erfolgt, weitergeleitet (vgl. Klinke 2001, 568).
Die sensorischen Zuflüsse zum Cortex können an allen Umschaltstellen (Rückenmark, Hirnstamm, Thalamus) durch
absteigende Bahnen gehemmt werden.
10 Ein Teil der Signale wird auf Interneurone verteilt, die zu den
Motoneuronen der Muskeln, zum Seitenhorn oder zum visceromotorischen Neuron gehen, wodurch bestimmte motorische (Fluchtreflexe) oder autonome Reaktionen (Gefäßkonstriktion oder -dilatation) in Gang gesetzt werden können.
5. Schmerzhemmung
Eine Hemmung des Schmerzes kann sowohl vom Organismus
selbst ausgehen als auch durch bestimmte medizinisch-therapeutische Maßnahmen von außen erfolgen.
5.1. Endogene Schmerzhemmung
Der menschliche Organismus verfügt über verschiedene
Möglichkeiten, die Schmerzempfindung und Schmerzwahrnehmung
selbst zu beeinflussen. Dies ermöglichen mindestens zwei Hemmsysteme.
Das erste Hemmsystem geht von Neuronen in der Substantia gelatinosa des Rückenmarks aus, die opiatähnlich wirkende Peptide
bilden. Sie hemmen die synaptische Erregungsübertragung von
nozizeptiven Afferenzen zwischen dem ersten und zweiten sensiblen Neuron im Hinterhorn des Rückenmarkes, also zwischen
dem ersten sensiblen Neuron und der Vorder-Seitenstrangbahn (vgl. Illes 1996, 203).
Das zweite Hemmsystem nimmt seinen Ursprung von Kerngebieten der Formatio reticularis und in der Pons gelegenen Raphe-Kernen.
Die absteigende Bahn führt in das Rückenmark und hemmt an der gleichen Stelle - ebenfalls durch Ausschüttung jener Peptide - die
Erregungsübertragung (vgl. ebenda).
5.2. Exogene Schmerzhemmung
In den Bereich der postoperativen exogenen Schmerzhemmung
fallen alle pharmakologischen, psychologischen und physikalischen Methoden. Sie haben das Ziel, Schmerzen kausal, und wenn das
nicht möglich ist, zumindest symptomatisch zu lindern.
Die Verfahren dienen dazu, die Aufnahme und Weiterleitung von Schmerzreizen bzw. deren Verarbeitung im ZNS zu verringern oder
zu verhindern, oder das Erleben und die Bewältigung von Schmerzen zu unterstützen. Verfahren aus der physikalischen
Therapie greifen meist unmittelbar oder über Reflexe in das
Schmerzgeschehen ein (vgl. Schmidt/Schaible 2000, 248).
6. Lokale pharmakologisch-physikalische Maßnahmen zur
Schmerzhemmung
6.1. Pharmakologische Maßnahmen: Das Medikament
Voltaren® Emulgel®
Voltaren® Emulgel® ist eine Salbe, die aufgrund ihrer entzündungshemmenden und schmerzstillenden Wirkung vor allem
bei Erkrankungen des rheumatischen Formenkreises Verwendung findet.
100g Gel enthalten als arzneilich wirksamen Bestandteil 1,16g
Diclofenac-Diethylaminsalz (vgl. Riess et al. 1986, 1092; Gebrauchsinformation Voltaren® Emulgel®
11 Hersteller: Novartis Pharma GmbH
Das Emulgel ist eine Gel-Creme-Mischung, die aus einem
alkoholischen Polyacrylat-Hydrogel besteht, in das eine lipophile Phase eingearbeitet ist. Diese ölige Phase wird durch eine
mehrschichtige Phasengrenzfläche, die aus dem amphiphilen Wirkstoff und dem Emulgator aufgebaut ist, stabilisiert (vgl.
Schöffling-Krause 1998, 327). Die Phasengrenzfläche bildet
flüssigkristalline Strukturen aus, die ein Depot für den Wirkstoff darstellen. Von hier aus kann das Diclofenac-Diethylamin in die
hydrophile Phase der Emulsion und von dort in die Haut abgegeben werden (vgl. ebenda).
Die biphasische Zusammensetzung der Gel-Creme-Mischung und
die Amphophilität des Wirkstoffes ermöglichen die Penetration und Permeationurch sowohl hydrophile als
auch hydrophobe Anteile der menschlichen Epidermis.
6.1.1. Der Wirkstoff Diclofenac
Diclofenac ist ein antiphlogistisch-antirheumatisch wirksames Derivat der Arylsäure und hemmt die Wirkung des Enzyms
Zyklooxygenase und damit die Biosynthese von Prostaglandinen
und Thromboxan aus Arachidonsäure (vgl. Hackenthal 1999, 246).
12 Die in dieser Arbeit verwendeten Begriffe zur Beschreibung der
Passage von Pharmaka in oder durch die Haut sollen an dieser Stelle definiert werden: - Penetration bezeichnet das Eindringen des Wirkstoffes in die Haut (vgl. Gronwald 1994, 7). - Permeation ist das Wandern des Stoffes durch eine oder mehrere
Hautschichten hindurch (vgl. Karzel/Liedtke 1989, 1487). - Resorption kennzeichnet die Aufnahme des Wirkstoffes in Blut- oder Lymphgefäße, die sich in der Dermis befinden (vgl. Karzel/Liedtke 1989, 1487).
Nach oraler Gabe liegen Diclofenac und seine Metaboliten im Blut
überwiegend als dissoziierte Säuren vor, die fast vollständig an Plasmaeiweiße gebunden sind (vgl. Brune 1986, 57).
Infolge der Kapillarschäden im entzündeten Gewebe treten die Plasmaeiweiße mit dem daran gebundenen Diclofenac in den
extravasalen Raum aus, wodurch es zu einer Anreicherung der
analgetischen Säuren im Extrazellularraum kommt (vgl. Engel/Ströbel 1990, 4.9).
Der Intrazellularraum besitzt in der Regel einen eher basischen pH-Wert um 7,0 (vgl. Brune et al. 1986, 58).
Begünstigt durch den erniedrigten pH-Wert, der grundsätzlich in
einem Entzündungsgebiet vorliegt, und die hohe Konzentration von Säuren im Extrazellularraum wandern die analgetischen Säuren
entlang eines Konzentrationsgefälles in den intrazellulären Raum, wo sie ihre Wirkung entfalten können (vgl. Brune et al. 1986, 58;
Schäfer 1997, 12).
Dort hemmen sie die Zyklooxygenase und damit die Synthese von Prostaglandinen.
Infolge des Prostaglandinmangels ist die analgetische Wirksamkeit von Substanzen wie Histamin oder Bradykinin verringert.
Außerdem werden Exsudation und nachfolgende Proliferation
6.1.2. Die transkutane Therapie
Bei der transkutanen Therapie wird das Medikament auf die intakte Hautfläche über einem entzündeten Gewebegebiet aufgetragen. Bis
zur Aufnahme in das Blut- bzw. Lymphsystem (Resorption) muß der Wirkstoff mehrere Grenzflächen überschreiten und sich in
verschiedenen Schichten der Haut verteilen (vgl. Kriwet 1994, 4).
Für den Transport des Wirkstoffes in und durch die Haut ist die
treibende Kraft die Diffusion entlang eines Konzentrationsgefälles (vgl. Loth 1989, 155).
Die erste Grenzfläche für einen suspendierten Wirkstoff ist die zwischen Wirkstoffdepot und hydrophiler Phase der Emulsion. Die
zweite die zwischen der hydrophilen Phase und der Haut.
Die weiteren Grenzflächen bilden die zu überschreitenden Schichten der Haut: die Hornschicht, die lebende Epidermis, die
Dermis mit ihren Blut- und Lymphgefäßen und die Subcutis. Weil es z.B. in der Hornschicht zu Bindungen des Arzneistoffes an
die dort befindlichen Lipide des Interzellularraumes oder an das
intrazelluläre Keratin kommen kann oder in den darunterliegenden Schichten Metabolisierungsreaktionen hinzutreten können,
verringert sich während des Penetrations- und Permeationsvorganges der Anteil des frei in das Gewebe
diffundierenden und seine Wirkung entfaltenden Wirkstoffes (vgl.
Kriwet 1994, 4).
Abb. 2. Vereinfachte und idealisierte Darstellung der Verteilung und
der Reaktionen eines Wirkstoffes in den verschiedenen Schichten der Haut
Suspendierter Wirkstoff
Phasengrenzfläche
Übergang Epidermis
Rezeptorwirkung
Rezeptorwirkung
Übergang Subcutis
(modifiziert nach Kriwet 1994, 3)
Das Haupthindernis für das Eindringen des Wirkstoffes in die Haut
stellt das Stratum corneum der Epidermis dar. Daß Diclofenac
durch die Haut permeieren kann, ist nachgewiesen (Takahashi et
6.1.2.1. Die menschliche Haut
Die Haut ist mit zwei Quadratmetern Oberfläche das größte Organ des Menschen. Sie bildet die äußere Begrenzung des Organismus
und garantiert durch ihr Epithel und durch Drüsensekrete in erster Linie Schutz vor physikalischen, chemischen und mikrobiologischen
Noxen sowie vor Wasser- und Elektrolytverlust (vgl. Wiechers
1989, 185). Sie erfüllt außerdem mit Hilfe ihres Gefäßsystems und der Schweißdrüsen thermoregulatorische Aufgaben und sie ist
Träger verschiedener Sinnesrezeptoren, die Informationen aus der Umwelt aufnehmen und an die Sinneszentren weiterleiten.
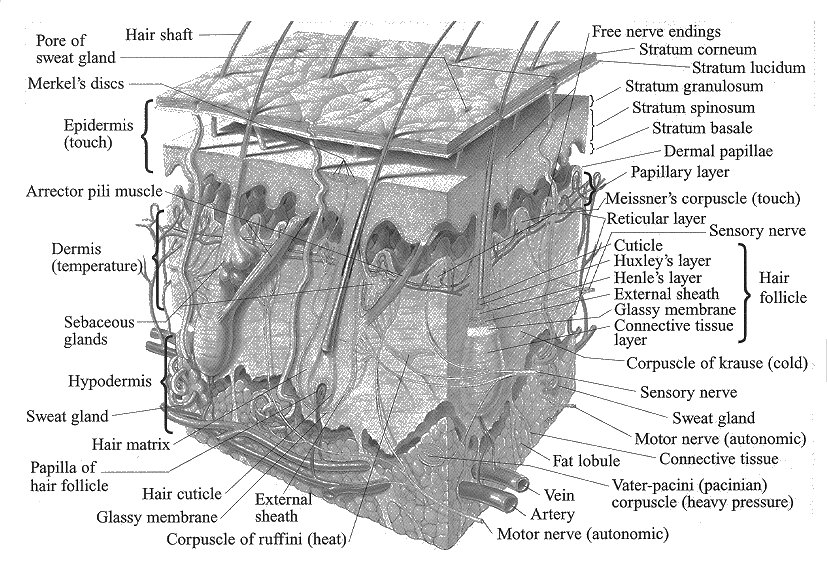
Abb. 3. Schematischer Aufbau der Haut
(BarCharts, Inc.® 1998, 6)
Die Haut ist hauptsächlich aus zwei Schichten aufgebaut: Einer
äußeren epithelialen Schicht (Epidermis) und einer inneren bindegewebigen Schicht (Dermis) (vgl. Fritsch 1985, 565).
Die Hautoberfläche ist bedeckt von einem dünnen Oberflächenfilm, der aus Talg, Schweißbestandteilen, losen Hautschuppen und
Bakterien besteht. Der pH-Wert beträgt 5,6 bis 6,6 (vgl. Kriwet 1994, 12). Bezüglich der Hemmung der Aufnahme von
Arzneistoffen spielt dieser Oberflächenfilm jedoch eine
untergeordnete Rolle (vgl. ebenda).
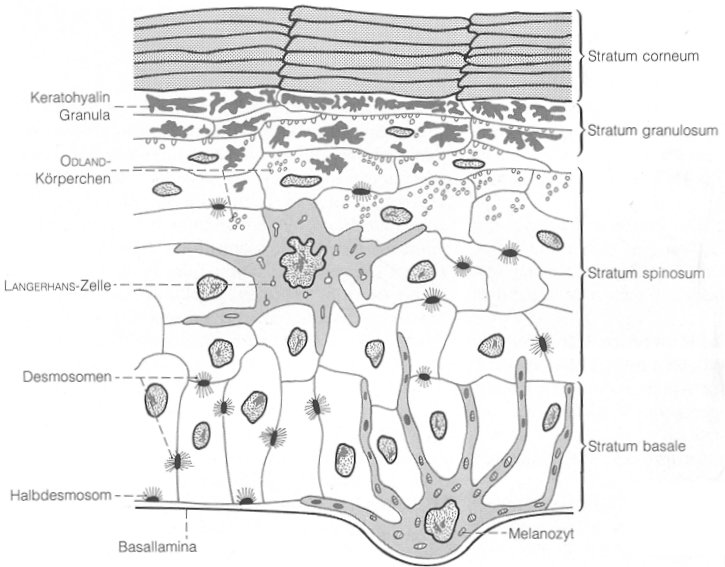
Abb. 4. Schematischer Aufbau der Epidermis
(Fritsch 1985, 568)
Die Epidermis ist ungefähr 0,04mm bis 1,2mm dick. Bei dem
Gewebe handelt es sich um geschichtetes Plattenepithel, das sich aus Zellen (Keratinozyten) in verschiedenen
Differenzierungsstadien zusammensetzt. Die Zellen wandern von
der Basalschicht (Stratum basale) über das Stratum spinosum und Stratum granulosum bis zum Stratum corneum (sogenannte
Hornschicht), das nur noch abgestorbene Zellen (Korneozyten) enthält.
Die Ernährung der gesamten Epidermis erfolgt durch Diffusion über
die Dermis (vgl. Kriwet 1994, 14).
Im Stratum basale liegen die Korneozyten in zylindrischer Form
vor. Die Zellen sind noch zur Zellteilung fähig und enthalten neben den üblichen Zellorganellen Proteinfilamente (Keratinfilamente), die
Vorläuferstrukturen des Keratins. Diese Filamente durchziehen gebündelt das Zytoplasma und bilden an der Zellmembran
Desmosomen (Haftplättchen) zu den Nachbarzellen aus (vgl.
Fritsch 1985, 568). Aufgrund ihres engen Kontakts zur Dermis liegt die Funktion dieser Schicht in erster Linie in der Ernährung der
Epidermis. Von ihr geht jedoch auch die Erneuerung des Epidermis aus.
Über dem Stratum basale liegt das zwei bis fünf Schichten breite
Stratum spinosum. Die Keratinozyten nehmen zur oberen Grenzschicht hin eine immer flachere Form an.
In den Zellen des oberen Stratum spinosum befinden sich Odland-Körperchen, die im Golgiapparat der Zelle gebildet werden. Sie
wandern in Richtung Zellmembran, verschmelzen mit der Zellwand
und geben ihren Inhalt, bestehend aus Glykoproteinen, Lipiden und Enzymen, durch Exozytose in den Interzellularraum ab (vgl. Kriwet
1994, 14). Diese Substanzen wandeln sich in breite, lamellierte Lipidschichten
um, die den Interzellularraum abrupt undurchlässig machen (vgl.
Fritsch 1985, 570).
Dem Stratum spinosum folgt das Stratum granulosum. In dieser Schicht finden sich in den Zellen Keratohyalingranula, die sich an
die Keratinfilamente anlagern und sie umschließen. Unter
Einwirkung des Enzyms Filaggrin, das im Keratohyalin enthalten ist, beginnt eine irreversible Aggregation und Polymerisation der
Keratinfilamente, wodurch die Verhornung der Keratinozyten in Gang gesetzt wird: Zellkern, Mitochondrien und Ribosomen,
Bestandteile einer lebenden Zelle, verschwinden und die Zelle stirbt
ab (vgl. Fritsch 1985, 570).
Die oberste Schicht der Epidermis bildet das Stratum corneum. Es besteht aus abgestorbenen, kernlosen Korneozyten. Diese sind mit
leicht hydrolysierbaren Keratin gefüllt und gelten damit als
hydrophilDie Zellmembran besitzt einen lipophilen Anteil, der zum
Zelläußeren weist und diesen an die Fette im Extrazellularraum bindet.
Die Zellen sind flach und besitzen eine hexagonale Form, die ein so
enges Aneinanderliegen der Zellen ermöglicht, daß nur sehr enge interzelluläre Spalten entstehen.
Der Interzellularraum des Stratum corneums besteht aus Triglyceriden, freien Fettsäuren, Cholesterol und Ceramiden (vgl.
Loth 1989, 158). Diese Lipide besitzen zwei Anteile: Einerseits
streng angeordnete und fast vollständig gesättigte und relativ lange Kohlenwasserstoffketten, deren Struktur nicht aufgebrochen
werden kann und für die meisten Substanzen inklusive Wasser undurchlässig ist (vgl. Wiechers 1989, 186). Andererseits besitzen
sie hydrophile Gruppen (z.B. Hydroxylgruppen) innerhalb des
Lipidgerüstes, die die Lipidschichten im wäßrigen Milieu der Interzellularsubstanz verankern.
Die Lipidschichten der Interzellularsubstanz des Stratum corneums
sind das Hauptpenetrationshindernis für den auf der Haut
applizierten Wirkstoff.
13 Das Keratin ist aus den Keratinfilamenten der Korneozyten des Stratum basale entstanden (vgl. Fritsch 1985, 568).
Eine Untersuchung zeigt, daß mit zunehmender Abtragung der
Fette die Barrierefunktion ab- und bei Hinzufügung wieder zunimmt (vgl. Smith et al. 1982, 7).
Unter der Epidermis befindet sich die Dermis.
Die Dermis ist eine fibroelastische Schicht aus kollagenem
Bindegewebe, das der Haut mechanische Festigkeit verleiht. Im Bereich des menschlichen Rückens ist sie erheblich dicker als z.B.
am Abdomen oder Oberschenkel, womit sich die geringere Permeationsrate eines dort applizierten Wirkstoffes erklären läßt
In der Dermis liegen Bindegewebszellen und freie Zellen des Immunsystems (z.B. Monozyten) sowie die Anhangsgebilde der
Haut, Haarwurzeln, Talg- und Schweißdrüsen (vgl. Leonhardt 1991, 342).
Die Dermis enthält außerdem die oberflächlichen Blutgefäße der
Haut und sensible und sympathische Nervenfasern. Das Gefäßsystem garantiert einerseits die Ernährung der Epidermis
über das Stratum basale. Andererseits sorgt es für den Abtransport von Diclofenac während der transkutanen Anwendung von
Voltaren® Emulgel® und baut damit den für die Diffusion
notwendigen Konzentrationsgradienten von der Hautoberfläche in die Tiefe auf.
Die Verbindung zwischen Haut und oberflächlicher Körperfaszie
stellt die Unterhaut (Hypodermis bzw. Subcutis) dar, die
überwiegend aus Fettgewebe besteht (vgl. derselbe 344). Sie trägt die größeren Gefäße und Nerven der Haut.
Neben dem Stratum corneum ist das dermale und subkutane
Kapillarnetz das zweite Haupthindernis für ein tieferes Eindringen
des Wirkstoffes durch Diffusionsvorgänge, weil er dort resorbiert
und über den Kreislauf systemisch verteilt wird.
Aus dem Aufbau der Haut wird ersichtlich, daß der Wirkstoff eines auf die Haut applizierten Medikamentes verschiedene - hydrophile
und hydrophobe - Anteile der Haut passieren muß, je nachdem, auf
welchem Weg er durch das Gewebe diffundiert.
In den verschiedenen Hautschichten finden sich neben den Keratinozyten bzw. Bindegewebszellen zahlreiche andere Zellen
(z.B. Monozyten, Langerhans-Zellen, Melanozyten) und die
Hautanhangsgebilde, aber auch Rezeptoren, die die Wahrnehmung von Sinnesreizen (vor allem Berührungs- und Schmerzreizen) aus
der Umwelt ermöglichen. Es handelt sich dabei um Nozizeptoren für die Schmerzempfindung und um Mechanosensoren für die
Berührungsempfindung (vgl. Zimmermann 2000, 217, 218).
Die nichtcorpusculären Nervenendigungen der Schmerzrezeptoren reichen bis in die untere Schicht des Stratum germinativum der
Zu den Mechanosensoren gehören die in der Epidermis bzw.
Dermis liegenden Merkel-Zellen und Ruffini-Körperchen. Physiologisch betrachtet handelt es sich um „Slowly-adapting"-
bzw. SA-Rezeptoren, die sehr langsam adaptieren und bei einem andauernden mechanischen Hautreiz eine entsprechend
fortlaufende Aktionspotentialserie an der afferenten Nervenfaser
erzeugen (vgl. Zimmermann 1990, 209). In der Dermis liegt das Meißner-Körperchen, ein „Rapidly-
adapting"- bzw. RA-Rezeptor, der nur auf bewegte mechanische Reize antwortet und in der Subcutis findet sich der „Pacinian
corpuscle" (sogenannter PC-Rezeptor), das sehr schnell
adaptierende Vater-Pacini-Körperchen. Dieser Rezeptor zeigt dann
Entladungen, wenn sich die Geschwindigkeit einer Hautdeformation ändert. Er gilt deshalb auch als Beschleunigungssensor (vgl.
Zimmermann 1990, 211). Die Fortleitung aller Berührungsreize erfolgt über afferente Gruppe-
II-(A-β)Fasern, die die Erregung mit einer Geschwindigkeit von
50m/s nach zentral leiten (vgl. Dudel 2000, 37). Die Erregungsleitung erfolgt damit wesentlich schneller als die der
Nozizeption (vgl. Kapitel 4.1.2.)
6.1.2.2. Penetration, Permeation und Resorption eines kutan applizierten Wirkstoffes
Der Penetrations-, Permeations- und Resorptionsprozeß eines
kutan applizierten Wirkstoffes erfolgt passiv durch Diffusion (vgl.
Loth 1989, 155).
Die Diffusion von Stoffen in bzw. durch das Stratum corneum der Haut findet in zwei Phasen statt. Die erste Phase ist eine initiale
Verzögerungsphase (sogenannte „lag-time"), während der der
Wirkstoff in die Hornhaut eindringt und sich ein Konzentrationsgefälle aufbaut (vgl. Stüttgen et al. 1986, 67).
Rougier et al (1990) konnten feststellen, daß diese Zeit für verschiedene andere Substanzen (Diclofenac wurde nicht
untersucht) annähernd gleich ist und im Mittel elf Minuten beträgt
(vgl. derselbe 500). Die Zeit bis zur Ausbildung eines konstanten Flusses („Steady State
Flux") beträgt bei allen Substanzen ungefähr 2,7mal so lange wie die „lag-time", also mindestens dreißig Minuten (vgl. ebenda).
Der „Steady-State-Flux" hält solange an, wie sich ausreichend
Substrat auf der Hautoberfläche befindet und gleichzeitig in den tieferen Schichten abtransportiert werden kann, so daß ein
Konzentrationsgefälle bestehen bleibt. Diese „Sink-Bedingungen" werden in erster Linie durch die in der Dermis befindlichen Gefäße
geschaffen, die den Wirkstoff abtransportieren.
Für die Passage des Wirkstoffes durch das Stratum corneum der
Haut gibt es drei Möglichkeiten:
1. durch die Schweiß- bzw. Talgdrüsen (transglandulär)
2. durch die Zellen der Epidermis (transzellulär) bzw. den
Interzellularraum der Epidermis (interzellulär).
Beim transzellulären Weg wandert der Wirkstoff entlang des hydrophilen Keratins und muß zusätzlich durch Teilbereiche der
Interzellularsubstanz diffundieren (vgl. Kriwet 1994, 19).
Beim interzellulären Weg bewegt er sich entlang der hydrophilen und hydrophoben Anteile der Lipidschichten.
3. durch die Wand der Haarfollikel (transfollikulär) (vgl. Barry
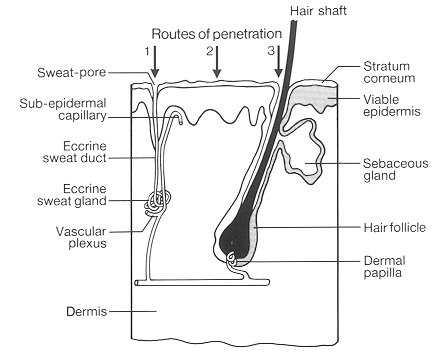
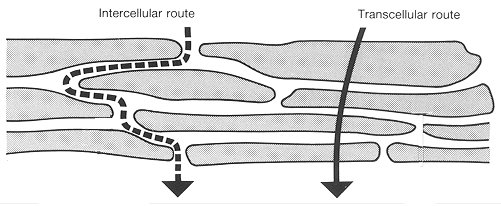
Abb. 5. Penetrationsrouten
(modifiziert nach Barry 1987, 122, 123)
Der Penetrationsweg ist einerseits vom Penetrationsstadium bzw. Penetrationszeitpunkt abhängig: Kurz nach dem Auftragen des
Wirkstoffes auf die Haut findet das Eindringen zunächst über die Haarfollikel und durch die Schweiß- und Talgdrüsen statt (vgl.
Scheuplein 1967, 79; Karzel/Liedtke 1989, 1487; Wiechers 1989,
186). Hat sich ein „Steady State" eingestellt, erfolgt die Penetration über
den interzellulären Weg (vgl. Loth 1989, 158). Auf der anderen Seite wird der Diffusionsweg auch vom
Molekulargewicht des Wirkstoffes bestimmt: Der transzelluläre Weg
ist in erster Linie für Moleküle mit niedriger Molekülmasse bis 2000 Dalton (Da) passierbar (vgl. Karzel/Liedtke 1989, 1488). Das
Molekulargewicht von Diclofenac-Diethylaminsalz beträgt 201Da und liegt damit unter 2000Da (vgl. Riess et al. 1986, 1092;
Schwister 1996, 66).
6.1.2.3. Physikalisch-biochemische Faktoren, die die Penetration, Permeation und Resorption beeinflussen
Nach der Freigabe des Wirkstoffes aus der aufgetragenen Gel-Creme-Mischung wird seine Ausbreitung in der Haut auf der einen
Seite von seinen pharmakologisch-biotechnischen Eigenschaften und auf der anderen Seite von den physiologischen Eigenschaften
der Haut bestimmt. Zu den Faktoren zählen: Die Gesetze der
Diffusion, der Partitionskoeffizient des Wirkstoffes und seine Löslichkeit, seine Masse, der pKa-Werts und der pH-Wert der Haut, die Temperatur und die Durchblutung des Gewebes.
14 Der pKa-wert ist der negative Logarithmus der Aciditätskonstanten
(vgl. Zetkin/Schaldach 1992, 1651).
1. Diffusionsgesetz In vivo- und in vitro Tierversuche von Rougier
et al. (1990) zeigen, daß sich die allgemeinen Gesetze der Diffusion auch auf Diffusionsvorgänge durch lebende
Membranen wie das Stratum corneum anwenden lassen (vgl. Rougier et al. 1990, 501).
Diclofenac diffundiert entlang seines Konzentrationsgefälles von
der Hautoberfläche (hohe Konzentration) in das Stratum corneum und die tieferen Schichten (niedrige Konzentration).
Nach dem Fick'schen Diffusionsgesetz ist bei konstantem Druck und konstanter Temperatur die Menge des pro Zeiteinheit dt (s)
diffundierten Stoffes dQ
(Mol) proportional dem
Konzentrationsunterschied dC (Mol/l) und der Austauschfläche F (cm2) und umgekehrt proportional dem Diffusionsweg dl (cm)
(vgl. Sinowatz 1996, 21). Außerdem geht die Diffusionskonstante D (cm2/s), die von der Teilchengröße und
Form des diffundierten Stoffes, von der Viskosität des
Lösungsmittels und der Temperatur abhängig ist, in die Gleichung ein (vgl. Zetkin/Schaldach 1992, 480).
Das 1. Fick'sche Gesetz lautet entsprechend:
D · F · dC.
Aus dem Gesetz läßt sich ableiten, daß die Menge des
diffundierten Stoffes um so größer ist, je größer das Konzentrationsgefälle und die Austauschfläche sind, je länger
die Applikation dauert und je kürzer der Penetrations- bzw.
Permeationsweg ist.
Rougier et al. (1990) konnten in ihren Tierversuchen zeigen,
daß mit zunehmender Applikationszeit die Menge der penetrierenden Substanz tatsächlich steigt (vgl. derselbe 500).
Bezüglich des Penetrationsweges läßt sich vorhersagen, daß dieser bei der Rückenhaut im Vergleich zu anderen Geweben
länger ist, weil die Dermisschicht eine wesentlich größere Dicke
aufweist (vgl. Fritsch 1985, 565). In entsprechenden Versuchen an der menschlichen Haut konnte festgestellt werden, daß
deshalb auch die Permeationsrate eines Wirkstoffes, der auf der Rückenhaut aufgetragen wurde, wesentlich geringer ist als an
Bauch, Oberschenkel oder Arm (vgl. Rougier et al. 1986, 456).
Auf der Grundlage des Diffusionsgesetzes läßt sich der „Steady
State Flux" des Wirkstoffes wie folgt bestimmen (vgl. Stüttgen et al. 1986, 66; Wiechers 1989, 188):
D · Kp · dC.
Js = k · dC =
Js ist der „Steady State Flux" des Wirkstoffes durch die Hornschicht (µg/cm·s), k der Permeabilitätskoeffizient (cm/s),
der bestimmt, wie die Ionendurchlässigkeit der Haut für den
Wirkstoff ist. Kp ist der Partitionskoeffizient des Wirkstoffes zwischen dem Stratum corneum und der Trägersubstanz und dl
die Länge (cm) des Penetrationsweges durch die Haut.
Der „Steady-State-Flux" eines Wirkstoffes ist nach dieser
Gleichung um so größer, je größer der Permeabilitätskoeffizient
und das Konzentrationsgefälle sind und je kürzer der
Penetrationsweg ist.
Weil es bei dem Transport des Wirkstoffes durch das Stratum corneum und die anderen Schichten der Haut zu den oben
beschriebenen Bindungen und Metabolisierungsreaktionen
kommen kann, ist zu berücksichtigen, daß diese mathematisch-physikalische Darstellung nicht vollständig dem tatsächlichen
Penetrationsvorgang entspricht.
2. Löslichkeit und Partitionskoeffizient des Wirkstoffes
Da Diclofenac ein amphiphiler Wirkstoff ist, besteht er aus einem hydrophilen und einem lipophilen Molekülanteil. Dadurch
ist er sowohl wasser- als auch fettlöslich. Eine gute Fettlöslichkeit ist Voraussetzung für das Diffundieren
in bzw. durch das eher lipophile Stratum corneum. Eine gute
Wasserlöslichkeit ist nötig, damit der Wirkstoff gut in die eher hydrophile Dermis gelangen und dort über die Gefäße
abtransportiert werden kann, weil dadurch das für eine hohe Diffusionsrate nötige Konzentrationsgefälle von der oberen in
die tiefere Schicht der Haut aufgebaut wird (vgl. Wiechers
1989, 189). Der Partitionskoeffizient des Wirkstoffes ist der Quotient aus der
Löslichkeit des Wirkstoffes im Stratum corneum und der in der Trägersubstanz. Je besser die Löslichkeit im Stratum corneum
ist (der Partitionskoeffizient steigt), desto größer ist die
Tendenz des Wirkstoffes, aus dem Vehikel heraus in die Haut zu diffundieren.
Rougier et al. (1990) konnten in ihren Versuchen nachweisen, daß der Partitionskoeffizient tatsächlich den Penetrationsfluß
beeinflußt (vgl. derselbe 498)
3. Molekülmasse
Substanzen mit einer geringeren Masse diffundieren besser und
schneller durch die Epidermis als schwerere (vgl. Karzel/Liedtke 1989, 1488; Gronwald 1994, 9).
Diclofenac besitzt mit ungefähr 201Da eine relativ geringe
4. pH-Wert der Haut und pKa- Wert des Wirkstoffes
Diclofenac weist wie viele nichtsteroidalen Analgetika eine
deutliche Säureeigenschaft auf. Der pKa-Wert beträgt 3,9 (vgl. Brune 1986, 51). Da der pH-Wert der Haut mit 5,6 bis 6,6 um zwei Einheiten über diesem Wert liegt, wird der Penetrations-
und Permeationsvorgang begünstigt, weil der Wirkstoff ausschließlich in nicht-protonisierter Form vorliegt (vgl.
Ritschel/Hussain 1988, 51).
Eine erhöhte Temperatur steigert die Brownsche e
Diffusionsrate steigt und der Penetrationsvorgang beschleunigt
Bezüglich des Einflusses der Durchblutung auf die
Permeationsrate gibt es unterschiedliche Meinungen: Stüttgen
et al. (1986) behaupten, daß für die Diffusion eines Wirkstoffes
15 Die Brownsche Molekularbewegung erfolgt aufgrund der ständigen unregelmäßigen Stöße, die die Teilchen der umgebenden Flüssigkeit (hier der Salbe) auf die Wirkstoffmoleküle ausüben (vgl. Zetkin/Schaldach 1992, 326).
in die Haut die Hornschicht der geschwindigkeitsbestimmende
Faktor ist, und deshalb eine Mehrdurchblutung die Permeationsrate nicht erhöhen kann (vgl. (Stüttgen et al. 1986,
71). Bei klinisch hyperämischer Haut sind die erhöhten Permeationsraten eher auf eine Schädigung der Hornschicht als
auf eine erhöhte Durchblutung der Haut zurückzuführen (vgl.
ebenda). Karzel/Liedtke (1989) und Ritschel/Hussain (1988) sind dagegen
der Ansicht, daß eine Mehrdurchblutung der Haut durch Vasodilatation durchaus zu einer erhöhten Permeationsrate führt
(vgl. Karzel/Liedtke 1989, 1489; Ritschel/Hussain 1988, 47).
Dies könnte damit erklärt werden, daß es durch die Mehrdurchblutung zu einem erhöhten Abtransport der in das
Plasma diffundierten Moleküle kommt. Dadurch entsteht ein größerer Konzentrationsgradient, der zu
einer vermehrten Permeation führen kann (vgl. Gronwald 1994,
10). Ändert sich jedoch, wie Stüttgen et al. (1986, 71) behaupten, dadurch nicht die Diffusionsrate durch das Stratum
corneum, kann nicht genügend Wirkstoff in die von Gefäßen versorgten Hautschichten nachfließen, um das
Konzentrationsgefälle auszugleichen.
6.1.3. Eindringtiefe und Wirkungsentfaltung von Diclofenac-Diethylammonium nach topischer Applikation
Die perkutane Resorption von Diclofenac-Diethylammonium aus 2 nicht
16 Das entspricht bei einem Wirkstoffgehalt von 1,16% einer Menge von 29mg Diclofenac-Diethylammonium.
okkludierter Rückenhaut des Menschen belassen wurde, beträgt
6% der applizierten Menge (vgl. Riess et al. 1986, 1092).
Riess et al. (1986) untersuchten an Meerschweinchen die Resorption von Diclofenac in das Gefäßsystem und kamen zu
folgendem Ergebnis:
5. Die Blutspiegel des radiomarkierten Diclofenac-Na verhielten
sich proportional zur Dosis, wobei die höchsten Werte nach vier bis sechs Stunden erreicht wurden (vgl. Riess et al. 1986,
5. Der Wirkstoff Diclofenac wird bei Voltaren®-Creme laufend
transdermal freigesetzt, solange die Creme aufgetragen bleibt. Sechs Stunden nach Entfernung der Cremereste werden lokale
Wirkstoffdepots rasch entleert (vgl. Riess et al. 1986, 1094).
5. „Steady-State"-Plasmaspiegel wurden nach zwei Tagen mit
einer dreimaligen Applikation pro Tag erreicht (vgl. Riess et al. 1986, 1094).
Konzentrationsmessungen in einzelnen Geweben menschlicher Probanden nach Auftragen des in verschiedenen Trägersubstanzen
befindlichen Wirkstoffes Diclofenac erfolgten durch Gronwald (1994), Schäfer (1997) und Karger (1992).
Die höchsten Wirkstoffkonzentrationen wurden in der Haut, in der
Subcutis und in der Muskulatur unter dem Applikationsort gefunden (vgl. Gronwald 1994, 48, 49; Schäfer 1997, 41).
Die gemessenen Medikamentenkonzentrationen lagen in diesen
Geweben im therapeutisch wirksamen Bereich, und waren im
Muskel sogar höher als bei oraler (2,3-fach höhere Konzentration)
oder rektaler Zufuhr von Diclofenac (vgl. Karger 1992, 51).Gronwald (1994, 61), Radermacher et al. (1991, 539) und Riess et
al (1986, 1095) konnten auch in nicht behandelten Geweben geringe Wirkstoffkonzentrationen nachweisen.
Deshalb kann davon ausgegangen werden, daß Diclofenac vom
Gefäßsystem der unter der Epidermis liegenden Hautschichten absorbiert und im gesamten Körper verteilt wird (vgl. Gronwald
Seine Anreicherung am Entzündungsort ist offensichtlich eine Folge
der Extravasion der Eiweiße mit dem gebundenen Diclofenac aus dem Gefäßsystem in diesem Bereich aufgrund der durch die
Entzündung bedingten Permeabilitätsveränderungen der Gefäßwände.
Dies läßt sich durch die Versuche Gronwalds (1994) bestätigen: Voltaren® Emulgel® wurde bei allen Patienten auf eines der
beiden entzündeten Kniegelenke aufgetragen (vgl. derselbe 42, 43, 46). Eröffnet und untersucht wurde bei einer Gruppe das
ipsilaterale Knie (Applikation und Operation am gleichen
Kniegelenk), bei der anderen das kontralaterale (Applikationsknie und operiertes Knie mit entnommenen Gewebe differieren).
17 Als Mindestkonzentration, die therapeutisch wirksam ist, wird jene Wirkstoffkonzentration verstanden, die eine mindestens fünfzigprozentige Hemmung der Prostaglandinsynthese bewirkt (Gronwald 1994, 62). Für Diclofenac beträgt die therapeutisch wirksame Konzentration in vitro 0,5µg/ml bzw. 1,6µmol/l (bzw. 1,6µmol/kg) bzw. 500ng/ml (vgl. ebenda, Fenner 1982, 1643). Es ist jedoch möglich, daß eine Hemmung der Prostaglandinsynthese im menschlichen lebenden Gewebe schon bei niedrigeren Konzentrationen eintreten kann.
In Plasma und Synovia wurden in beiden Gruppen annähernd
gleiche Konzentrationen gefunden (vgl. Gronwald 1994, 41, 42).
In den Geweben direkt unter dem Applikationsort Haut, Subcutis und Muskulatur kann dagegen eine Anreicherung des Wirkstoffes
durch direkte Diffusion angenommen werden:
Erstens, weil die Konzentrationen überdurchschnittlich hoch sindund zweitens, weil sie weit über den Plasmakonzentrationen der
gleichen und den entsprechenden Gewebekonzentrationen der kontralateralen Seite liegen (vgl. derselbe 48, 49, 44).
Alle Untersuchungen machen deutlich, daß es bezüglich des Wirkstoffgehalts verschiedener Gewebe (Plasma,
Synovialflüssigkeit, Haut, Muskulatur usw.) starke interindividuelle Unterschiede gibt.
Von allen Untersuchern wurden in der Haut, Subcutis und in der Muskulatur am Applikationsort Diclofenacspiegel im therapeutisch
wirksamen Bereich gefunden. So kann davon ausgegangen werden, daß zumindest in den durch
die Bandscheibenoperation verletzten oberflächlichen Geweben wie
Haut, Unterhaut und der gereizten paravertebralen Muskulatur das lokal applizierte Voltaren® Emulgel® seine therapeutische
Wirksamkeit entfalten kann.
18 Sie betrugen in der Haut unter der Applikationsstelle 12509,00 bis 225224,00 nmol/kg, das entspricht 12,509 bzw. 225,224µmol/kg, in der Subcutis bis zu 2620nmol/kg und in der Muskulatur im Durchschnitt
300nmol/kg (vgl. Gronwald 1994, 48, 49, 44). Schäfer (1997, 39) fand in oberflächlichen Hautschichten Konzentrationen von 532 +/-197µg/ml bzw. in tieferen Schichten 438 +/-249µg/ml. Das sind therapeutisch wirksame Konzentrationen.
Zu prüfen bleibt jedoch, ob von Diclofenac nicht möglicherweise
neben der antiphlogistischen und analgetischen noch andere Wirkungen im Operationsgebiet ausgehen können.
6.1.3.1. Die Nebenwirkungen von auf der Haut appliziertem
Die in der Haut und Subcutis gefundenen Diclofenackonzentrationen liegen im therapeutisch wirksamen
Bereich. Das heißt, daß die Prostaglandinsynthese zu mindestens
50% gehemmt werden kann. Damit tritt einerseits in den entsprechenden Geweben eine
Schmerzlinderung ein. Andererseits erfolgt jedoch eine Minderung der Gefäßdilatation und Extravasion sowie eine Hemmung der
Thrombozytenaggregation, beides die Wundheilung fördernde
Reaktionen, die durch die Anwesenheit der Prostaglandine im Entzündungsgebiet in Gang gesetzt werden.
Sedlarik (1993) geht davon aus, daß bei der Verabreichung von
antientzündlichen Substanzen eine negative Beeinflussung der
entzündlichen Phase der Wundheilung, die in den ersten drei Tagen stattfindet, erwartet werden kann. Nachgewiesen ist es für
glukokortikoid- und salizylathaltige Substanzen (vgl. derselbe 149).
Diwan/Kulkarni (1986) untersuchten den Einfluß von Indometacin
auf die verschiedenen Phasen der Wundheilung bei Ratten. Dabei wählten sie für diese Tiere eine Dosis entsprechend Körpergröße
und Gewicht, die der einem Menschen verabreichten Höchstdosis
19 ebenso wie Diclofenac ein Arylsäurederivat
entspricht (vgl. Divan/Kulkarni 1986, 640). Sie fanden heraus, daß
der Wirkstoff die Wundkontraktion verlangsamt und eine größere Narbe als bei der Kontrollguppe ohne Medikament hinterläßt, die
Epithelisation aber nicht beeinflußt (vgl. derselbe 641, 643). Dvivedi et al. (1997) stellten ebenso im Tierversuch fest, daß
Diclofenac die Festigkeit des Narbengewebes herabsetzt. Die
verabreichte Dosis war allerdings zehnmal so hoch wie eine in der Klinik verwendete (vgl. derselbe 1243, 1244).
Die Ergebnisse sind auf eine lokale Therapie mit nichtsteroidalen Antirheumatika übertragbar, weil die Wirkstoffkonzentrationen, die
bei Probanden in der Haut und Unterhaut am Applikationsort durch
das Einreiben erreicht werden, noch höher sind als durch orale Gabe des Medikamentes (vgl. Karger 1992, 62).
Insofern lassen die Untersuchungen zum Einfluß von NSA auf die
Wundheilung den Schluß zu, daß Diclofenac in Konzentrationen,
wie sie in der Haut und Unterhaut gefunden wurden, die entzündliche Phase der Wundheilung beeinflussen kann.
Bei einer topischen Therapie mit oder ohne Strom ist deshalb zu berücksichtigen, daß das Gel entfernt von der Narbe aufgetragen
werden muß. Unklar ist, ob indirekt über die systemische
Verteilung von Diclofenac wundheilungsstörende Konzentrationen im Narbenbereich erreicht werden könnten.
6.2. Elektro-physikalische Maßnahmen: Die Iontophorese
„Iontophoresis is a modern technique of drug delivery by which
charged bioactive molecules (drugs) are transferred from an elektrolytic reservoir, usually an aqueous based solution or
hydrogel, into and through a tissue, normally skin, by means of a
weak elektric current." (Kiomars 1999, 1)
Bei dem in der elektrotherapeutischen Praxis verwendeten Strom handelt es sich um galvanischen Strom, einen nach A. Galvani
benannten elektrischen Gleichstrom. Dieser kontinuierlich in eine
Richtung fließende Strom besitzt eine relativ hohe Intensität, aber niedrige Spannung (vgl. Zetkin/Schaldach 1992, 805).
Es werden zwei Formen des Gleichstroms unterschieden:
1. Der kontinuierlich fließende Gleichstrom, der über längere Zeit
mit konstanter Intensität fließt.
2. Die Gleichstromkomponente bestimmter Reizströme (vgl. Senn
1990, 25). Hier zergliedern periodische Schließungen und Öffnungen des Stromkreises den Gleichstrom in einzelne
Gleichstromimpulse. Hauptvertreter dieser Stromform sind die
Reizströme nach Bernard. Durch die Impulse entsteht im Vergleich zum kontinuierlich fließenden Gleichstrom eine
stärkere elektrische Reizwirkung im Gebiet der Kathode (vgl. ebenda).
Für die Applikation eines Medikamentes wird in der
elektrotherapeutischen Praxis hauptsächlich der kontinuierlich fließende Gleichstrom verwendet
6.2.1. Die biophysikalische und elektrochemische Wirkung des
galvanischen Stromes
Durch das Anlegen zweier Elektroden (Anode und Kathode) auf die menschliche Haut bei der Elektrotherapie werden ein Leiter erster
Ordnung (Elektroden) und ein Leiter zweiter Ordnung (der
menschliche Körper) miteinander verbundenDie beiden Elektroden stehen mit einer Gleichspannungsquelle
(dem Elektrotherapiegerät) in Verbindung. Der unterschiedliche Elektronenbestand an den Elektroden (Kathode: Überschuß an
Elektronen, Anode: Mangel an Elektronen) ruft eine Spannung im
Gewebe, vor allem im Bereich der Haut unter den Elektroden, hervor (vgl. Steuernagel 1992, 44). Diese Spannung führt zum
Wandern von Ionen (sogenannte Elektrophorese), mit dem Ziel, einen Spannungsausgleich zu schaffen. Dabei wandern die negativ
geladenen Ionen (Anionen) zur Anode und die positiv geladenen
Ionen (Kationen) zu Kathode:
20 Senn macht jedoch den Vorschlag, bei Medikamenten, die unter der
Kathode appliziert werden, einen Reizstrom einzusetzen, damit die analgesierende Wirkung des Medikamentes durch die Reizwirkung des Stromes unter der Kathode verstärkt wird (vgl. Senn 1990, 35).
21 Der menschliche Körper gilt wegen seines hohen Flüssigkeits- und Elektrolytgehalts als Leiter zweiter Ordnung (vgl. Steuernagel 1995, 1124).
„Diese Wanderung der Ionen in entgegengesetzten Richtungen ist
der elektrische Strom im Elektrolyten, denn mit dieser Wanderung ist der Ladungstransport verbunden." (Steuernagel 1992, 45)
Bei den Ionen handelt es sich in erster Linie um die Ionen des
Wassers, weil deren Beweglichkeit am größten ist, aber auch um
Proteine, Säuren, Basen und die Kat- und Anionen des lebenden Organismus, die von einer Hydrathülle umgeben sind (Na+, Cl-,
Bei der Verwendung von Metallelektroden werden unter der Anode
bzw. Kathode die Ionen des Wassers chemisch umgesetzt, was als Elektrolyse bezeichnet wird (vgl. Pratzel 1985, 9): Die Ionen
werden an ihrer Oberfläche neutralisiert, wobei folgende Reaktionen stattfinden:
An der Kathode werden die „überschüssigen" Elektronen auf
Wasserstoffionen übertragen. Es entstehen neutrale Wasserstoffatome und daraus Wasserstoffgas, das entweicht. Als
Gegenionen verbleiben OH--Ionen, die ein alkalisches Milieu verursachen (vgl. Steuernagel 1992, 45).
An der Anode kommt es zur Entladung von OH--Ionen, wodurch
OH-Radikale entstehen, aus denen Sauerstoff hervorgeht (vgl. Pratzel 1985, 8). Als Gegenionen bleiben H+-Ionen übrig, die eine
saure Zone entstehen lassen (vgl. ebenda). Die Wasserstoff- bzw. OH-Radikale sind chemisch äußerst aktiv und
es ist zu berücksichtigen, daß das bei der Iontophorese
eingebrachte Medikament durch sie chemisch verändert werden kann.
Außerdem übernehmen die H+-Ionen den Transport von Ladungen, wodurch das geladene Medikamentenmolekül sich weniger und
langsamer im elektrischen Feld bewegt (vgl. Ashburn et al. 1992,
31). Die chemischen Reaktionen unter den Elektroden limitieren die
Anwendungsdauer der Iontophorese auf bis zu zwanzig Minuten, die wiederum nicht ausreichen, um therapeutisch wirksame
Konzentrationen im Blutkreislauf bzw. und in den entzündeten
Geweben zu erreichen. (vgl. ebenda).
6.2.2. Die biophysikalischen und elektrochemischen Vorgänge in
der Haut bei der Iontophorese
Die angelegte Gleichspannung wird bei der Iontophorese dafür
genutzt, das Medikament besser in die Haut zu bringen. Voraussetzung dafür, daß der Wirkstoff transportiert werden kann,
ist, daß er in ionisierter Form vorliegt. Diclofenac-Diethylaminsalz
ist ein Anion (vgl. Bremerich/Wiegel 1988, 842; Engel/Ströbel 1990, 2.103).
Der Transport des ionisierten Stoffes erfolgt unter dem Einfluß
eines elektrischen Feldes durch Ladungstransport nach den
Faraday-Gesetzen (vgl. Pratzel 1987, 24). Bei entsprechendem elektrischen Widerstand der Haut ist der Transport dabei abhängig
von der elektrischen Spannung und nicht wie bei der Diffusion nach den Fick'schen Gesetzen von der Konzentration des Wirkstoffes.
Das erste Faraday-Gesetz sagt aus, daß die bei der Verbindung eines Leiters erster und eines Leiters zweiter Ordnung an den
Elektroden abgeschiedenen Stoffmassen m direkt proportional der Stromstärke I und der Zeit t des Stromflusses sind (vgl. Meyers
Lexikonredaktion 1988, 141):
Das heißt, die Menge aller abgeschiedenen Ionen, also auch der Wirkstoffionen, steigt mit zunehmender Stromintensität und
andauerndem Stromfluß
Das zweite Gesetz besagt, daß die durch die gleiche
Elektrizitätsmenge abgeschiedenen Mengen verschiedener Ionen (k1, k2) sich so zueinander verhalten wie ihre Quotienten aus relativer Molekülmasse M und elektrochemischer Wertigkeit z
(vgl. Zetkin/Schaldach 1992, 668).
Diclofenac-Diethylaminsalz besitzt im Vergleich zu den Ionen des
Wassers und den Elektrolyten des menschlichen Körpers eine sehr
große Masse und eine geringe Wertigkeit, so daß es sich im Vergleich zu diesen langsamer im elektrischen Feld bewegt.
Die Aminosäuren der Hornschicht sind gegenüber den Natrium- und Chloridionen jedoch ebenfalls schlechter beweglich, was wiederum
das Wandern der Medikamentenmoleküle in die Hornschicht zum
Ladungsausgleich begünstigen könnte (vgl. Pratzel 1985, 15).
22 Ä ist das elektrochemische Äquivalent, das angibt, wieviel Gramm des betreffenden Ions pro Coloumb abgeschieden werden (vgl. Zetkin/Schaldach 1992, 668). Die Ladung von einem Coloumb wird durch einen Leiter transportiert, wenn während einer Sekunde ein Strom mit
der Stärke 1 Ampere fließt (vgl. Zetkin/Schaldach 1992, 417).
23 Die elektrochemische Wertigkeit bezeichnet die Anzahl der von einem bestimmten Atom gebundenen oder durch dieses Atom in einer anderen Verbindung ersetzten Wasserstoffatome (vgl. Schwister 1996, 186).
Für einen höheren Transport des Wirkstoffes im elektrischen Feld bei einer Iontophorese gegenüber der freien Diffusion beim
alleinigen Auftragen auf die Haut gibt es einen Hauptgrund:
„Es stellt sich sofort nach Einschalten der Spannung maximaler
Ladungstransport auf den möglichst kurzen Wegen der leitfähigen Bahnen durch die Hornschicht ein. Die Ionen folgen den
elektrischen Feldlinien auf einer effektiveren Vorzugsrichtung." (Pratzel 1985, 18)
Unterhalb der Hornschicht erfolgt die Stoffausbreitung in erster Linie durch Diffusion. Der Transport des Pharmakons kann durch
die Elektrophorese gegenüber der Diffusion nicht erhöht werden, weil die unter der Haut erreichten Feldstärken von 50mV/cm zu
gering sind (vgl. Pratzel 1985, 21). In diesen Gewebeschichten
erfolgt also kein stromunterstützter Medikamententransport. Durch die infolge der Iontophorese erreichten höheren
Medikamentenkonzentrationen im Stratum corneum der Haut erhöht sich jedoch das Konzentrationsgefälle und damit die
Diffusionsrate in die lebende Epidermis, Dermis und Gefäße.
Die schmerzlindernde Wirkung des Medikamentes ist bereits in
Kapitel 6.1.1. beschrieben worden. Bei der Iontophorese wird dieser biochemische Effekt unterstützt durch die analgesierende
Wirkung des galvanischen Stromes im Gewebe unter der Anode
und unter der Kathode.
6.2.3. Die analgetische Wirkung des galvanischen Stromes
Die Veränderung des Elektrolytmilieus durch das Anlegen einer
elektrischen Gleichspannung führt unter den Elektroden zur Beeinflussung des Ruhemembranpotentials erregbarer Membranen
in der Haut wie z.B. der Nozizeptoren oder der
Berührungsrezeptoren. Unter der Anode bzw. Kathode finden an solchen Membranen
unterschiedliche Reaktionen statt, die als Anodenwirkungen bzw. kathodische Depression oder Kathodenblock bezeichnet werden
(vgl. Zetkin/Schaldach 1992, 112, 1091).
6.2.3.1. Das Ruhemembranpotential erregbarer Membranen
Das Ruhemembranpotential ist eine elektrische Potentialdifferenz
an den Membranen lebender Zellen. Es beträgt in Abhängigkeit vom Zelltyp 50-100mV (vgl. Silbernagl/Despopoulos 1991, 24).
Das Ruhemembranpotential ist das Ergebnis einer ungleichen Ionenverteilung zwischen dem extrazellulären und dem
intrazellulären Raum, die durch aktive Transportprozesse der Zelle
aufgebaut und aufrecht erhalten wird: Na+-Ionen werden aus der Zelle hinaus, K+-Ionen in die Zelle hinein transportiert. Die K+-
Konzentration ist infolgedessen in der Zelle zunächst wesentlich höher als außen, die Na+-Konzentration intrazellulär viel niedriger
als extrazellulär.
Da die Zellmembran für Na+-Ionen nur wenig durchlässig ist, können die Ionen zum Konzentrationsausgleich nicht zurückfließen.
Außerdem können die negativ geladenen Proteine und Phosphate der Zelle die Membran kaum permeieren.
Dagegen ist die Zellmembran für K+-Ionen relativ gut durchlässig,
so daß diese Ionen entsprechend ihres Konzentrationsgefälles aus dem intra- in den extrazellulären Raum diffundieren können.
Die diffundierenden Kaliumionen führen eine positive Ladung mit sich und bauen - weil auch weder intrazelluläre Anionen folgen
noch kaum positiv geladene Na+-Ionen aus dem extrazellulären
Raum zum Ladungsausgleich in die Zelle wandern können - ein Diffusionspotential auf. Dieses Diffusionspotential steigt solange
an, bis ein weiterer, dem Konzentrationsgradienten folgender Kaliumausstrom durch das ansteigende elektrische Potential
verhindert wird (vgl. Silbernagl/Despopoulos 1991, 24).
Dieses Potential treibt außerdem intrazelluläre negativ geladene Chloridionen entgegen dem eigenen chemischen Gradienten aus
der Zelle. Schließlich stellt sich ein Gleichgewichtspotential für K+ und Cl-
einträgt für Kalium ungefähr -95mV, für Chlor -80mV (vgl.
6.2.3.2. Die Beeinflussung des Ruhemembranpotentials durch den
galvanischen Strom
Unter der Anode wandern Chloridionen mit ihrer Hydrathülle in
Richtung Anode. Damit steigt im Extrazellularraum um die Membran die Konzentration positiv geladener K+- und Na+-Ionen
und damit das Ruhemembranpotential (sogenannte
Hyperpolarisation). Infolge dieser Hyperpolarisation ist für eine Erregung der Zelle eine größere Reizintensität erforderlich. Die
24 Gleichgewichtspotential heißt, daß der die Kaliumionen entsprechend
des Konzentrationsgefälles hinaustreibende chemische Gradient genauso groß ist wie der elektrische Gradient, also die elektrische Kraft, die sie zurücktreibt.
vorhandene Konzentration spezifischer schmerzauslösender
Substanzen reicht möglicherweise nun nicht mehr aus, die Zelle zu erregen.
Unter der Kathode bewegen sich positiv geladene K+- und Na+-
Ionen in Richtung Kathode. Dies führt zur Verringerung des Anteils
der positiv geladenen Ionen im Extrazellularraum und zur Senkung des Ruhemembranpotentials. Je nachdem, wie weit sich das
Potential verringert, kann das Schwellenpotentialt werden oder nicht.
Wird es erreicht, kommt es zur vollständigen Depolarisation der
Zelle. Die depolarisierte Zellmembran eines Nozizeptors kann nicht mehr
durch spezifisch schmerzauslösende Substanzen erregt werden (sogenannter Kathodischer Block).
Wird das Schwellenpotential nicht erreicht, genügt ein Reiz mit
geringer Intensität (z.B. schmerzauslösende Substanzen in geringer Konzentration), ein Aktionspotential der Zelle
herbeizuführen: Die Zelle wird erregt, die Erregung wird fort geleitet und der Schmerz zentral wahrgenommen. In diesem Fall
würde der Strom die Reizung der Nozizeptoren und die
Schmerzwahrnehmung unterstützen. Um also eine vollständige Depolarisation der Zellmembran zu
erreichen, sollte die Stromintensität so hoch wie möglich gewählt werden.
25 Schwellenpotential ist das elektrische Potential der Membran, bei dem es zur Entstehung eines Aktionspotentials kommt, also zur Erregung der Zelle und zum Weiterleiten der nozizeptiven Afferenzen.
Im Fall der verminderten Erregbarkeit freier Nervenendigungen
durch Hyper- bzw. Depolarisation ist der galvanische Strom analgetisch wirksam.
Abb. 6. Bildliche Darstellung der biophysikalischen und
elektrochemischen Vorgänge im Gewebe unter den Elektroden
Unter der Kathode
Unter der Anode
(modifiziert nach Pratzel 1985, 9)
Das Ausmaß der Veränderungen im Ionenmilieu ist abhängig von der Gesamtmenge des Stromes, die einen bestimmten
Körperabschnitt durchfließt. Die Gesamtstrommenge ist
proportional dem Produkt aus Stromstärke und Behandlungszeit.
Es ist möglich, daß nicht nur die Nozizeptoren der Haut gereizt werden, sondern auch die dort befindlichen Mechanosensoren, die
ebenfalls erregbare Membranen besitzen durch den galvanischen
Strom gereizt werden können. Da die Fortleitung der Erregung dieser Zellen schneller von statten geht als die der Nozizeptoren
(50m/s gegenüber 15m/s) kann es auf spinaler Ebene zu einer Hemmung der langsamer leitenden nozizeptiven Fasern kommen
(vgl. Handwerker et al. 1975, 147).
Um eine optimale Reizwirksamkeit durch den Strom zu erreichen,
ist eine genügend lange Stromflußdauer Voraussetzung, weil die Membranen nicht beliebig schnell erregbar sind.
Sie wird auch – wie unten noch gezeigt wird – dafür benötigt, bei
der Iontophorese das Medikament wirksam in den Körper zu bringen.
6.2.4. Die Wirkung der Iontophorese mit einem NSA im Vergleich
zu anderen Applikationsformen des Medikamentes bzw. anderen Iontophoreseformen
Zu der Wirksamkeit der Iontophorese mit einem NSA im Vergleich
zu anderen Applikationsformen des Medikamentes bzw. zu anderen
Formen der Iontophorese liegen verschiedene experimentelle und klinische Studien vor. Schuhfried/Fialka-Moser (1995) fanden unter
Zuhilfenahme der Datenbank „Medline" (Untersuchungszeitraum von 1984 bis 1993) eine experimentelle Humanstudie und drei
klinische Studien. Eine neuere klinische Studie liegt von
Demirtas/Öner (1998) vor.
Die experimentellen Studien erfolgten durch Pratzel (1985). Er untersuchte die Medikamentenkonzentrationen in Plasma und Urin
bei gesunden menschlichen Probanden nach der Applikation der
Wirkstoffe Indometacin bzw. Salicylsäure durch Iontophorese im Vergleich zum Einreiben eines den Wirkstoff enthaltenen Gels
(Amuno®-Gel mit Indometacin) oder einem mit Salicylsäure angereicherten Teilbad (derselbe 1985, 34, 35).
Die Studien ergaben, daß nach einstündiger iontophoretischer Applikation von Indometacin auf dem menschlichen Rücken
(Fläche: 1380cm2) nach zwei Stunden die Plasma- und Urinkonzentrationen deutlich höher waren als nach der topischen
Applikation des Medikamentes (vgl. ebenda; Pratzel et al. 1986,
74). Die Applikation von Salicylsäure auf einer Fläche von 400cm2 fünf
Tage lang für eine Stunde führte im Vergleich zu einer Anwendung ohne Strom ebenso zu signifikant höheren Plasma- und
Urinkonzentrationen (vgl. Pratzel 1985, 34).
Im Plasma lag die Konzentration eine Stunde nach einer
Nach einer einstündigen Salicylsäure-Iontophorese über fünf Tage hinweg wurden ab dem vierten Tag im Plasma noch höhere
Konzentrationen erreicht, die sogar im therapeutisch wirksamen
Bereich lagen (über 500ng/ml). Die Verdoppelung der Iontophoresezeit von dreißig auf sechzig
Minuten bei gleicher Stromdichte steigerte die renale Elimination
26 das ist keine therapeutisch wirksame Konzentration.
von Salicylsäure um das fünf- bis zehnfache (vgl. Pratzel 1985,
In den klinischen Studien wurde die therapeutische Wirksamkeit der Iontophorese mit nichtsteroidalen Antirheumatika im Vergleich
zu anderen Applikationsformen untersucht.
Als Parameter wurden die Veränderung der Spontan-, Druck- und Bewegungsschmerzhaftigkeit (Demirtas/Öner 1998;
Vecchini/Grossi 1984; Pavelka et al. 1988), der Beweglichkeit und Schwellung (Vecchini/Grossi) und der Funktion (Demirtas/Öner;
Vecchini/Grossi) herangezogen.
Vecchini/Grossi (1984) konnten bei Patienten mit Periarthropathia humeroscapularis (PHS) und einer Epicondylitis humeri lateralis
durch eine Diclofenac–Iontophoreseserie im Vergleich zu einer NaCl-Iontophoreseserie eine signifikant größere Reduktion des
Spontan-, Druck-, und Bewegungsschmerzes erreichen (vgl.
derselbe 346). Der Parameter „Schwellung" konnte gegenüber der Iontophorese
mit einer Natriumchloridlösung nicht verbessert werden. Die Frequenz mit einmal täglich zwanzig bis dreißig Minuten und
die Anzahl der Sitzungen (zwanzig) waren sehr hoch.
Die Untersuchung gibt keinen Aufschluß darüber, wie der Druckschmerz provoziert wurde. Für die Beurteilung des Schmerzes
wurde eine Vier-Punkte-Skala („no pain" bis „severe pain") herangezogen. Die Studie war randomisiert.
27 Randomisierung heißt, daß die Teilnehmer der Studie nach dem Zufallsprinzip in die einzelnen Studiengruppen verteilt werden, und jeder
Teilnehmer die gleiche Chance hat, in die eine oder andere Gruppe zu kommen.
28 Eine Studie ist verblindet, wenn diejenigen (Ärzte, Therapeuten,
Statistiker), die das Ergebnis beurteilen oder es auswerten, nicht wissen, welcher Gruppe der Patient zugeordnet wurde, und die Patienten nicht wissen (soweit dies möglich ist), welche Therapie sie bekommen.
Pavelka et al. (1988) stellten in ihrer Studie fest, daß eine
einmalige zwanzigminütige Iontophorese mit Mobilisinsalbe (Wirkstoff: Flufenaminsäure) die Schmerzhaftigkeit (Visuelle
Analogskala nach Huskisson) nicht signifikant mehr linderte, als Mobilisinsalbe einmalig ohne Strom angewendet (vgl. derselbe
Die Iontophorese mit Mobilisinsalbe war wirksamer als die Iontophorese mit Plazebosalbe und die Anwendung von
Mobilisinsalbe mit Scheinstrom war wirkungsvoller als eine Iontophorese mit Plazebo (vgl.ebenda).
In dieser Studie erfolgte keine Randomisierung oder Verblindung.
Die randomisierte aber nicht verblindete Studie von Demirtas/Öner
(1998) untersuchte die Wirksamkeit einer Iontophorese mit Diclofenac-Natrium und Salicylat-Natrium bei Patienten mit einer
Epicondylitis lateralis. Nach der Behandlung erhielten beide
Gruppen eine Infrarotbehandlung (vgl. derselbe 24). Die Behandlung erfolgte fünfmal in der Woche einmal täglich für
zwanzig Minuten an achtzehn Tagen. In der mit Diclofenac-Natrium behandelten Gruppe sind
Druckschmerzhaftigkeit und Schmerzhaftigkeit bei Bewegung
gegen Widerstand signifikant mehr zurückgegangen als in der zweiten Gruppe (vgl. derselbe 26). Die Beurteilung des Schmerzes
erfolgte ebenfalls mittels einer Vier-Punkte-Skala. Auch aus dieser Studie kann nicht entnommen werden, wie der
Druckschmerz provoziert wurde.
In allen Studien war die Anzahl der Probanden zu gering, um den
Schluß ziehen zu können, daß die festgestellten signifikant positiven Wirkungen nicht zufällig eingetreten sind.
Des weiteren war die Anzahl der Kontrollgruppen zu gering, um
eine Aussage darüber machen zu können, wodurch eine mögliche schmerzlindernde Wirkung eingetreten ist, ob durch das
Medikament, einen möglichen Plazeboeffekt oder den galvanischen Strom.
Weiterhin ist ein Druckschmerz, der mit großer Wahrscheinlichkeit
manuell durch einen Therapeuten ausgeübt wurde (die Studien geben keinen Hinweis auf andere Mittel) nicht quantifizierbar,
objektivierbar oder meßbar. Die Beurteilung der Schmerzstärke nach einer Vier-Punkte-Skala
ermöglicht lediglich eine Qualifizierung des Schmerzes, aber nicht
dessen Quantifizierung.
Schließlich waren die Applikationszeiten von zwanzig Minuten zu kurz, um einen klinischen Effekt erreichen zu können, weil
wirksame Medikamentenkonzentrationen erst bei einer
Behandlungszeit von über dreißig Minuten über mehrere Tage hinweg erreicht werden können, wie die Untersuchungen von
Pratzel zeigen (vgl. Pratzel 1985, 34, 35).
In der Studie von Pavelka et al. (1988) wurde jeder Patient
innerhalb von zwei Tagen einmal mit jeder der vier Therapieformen (Mobilisinsalbe mit Iontophorese, Mobilisinsalbe mit Schein-
Iontophorese, Plazebosalbe mit Iontophorese bzw. Plazebo-Salbe mit Schein-Iontophorese) behandelt (vgl. derselbe 234). Das heißt,
es erfolgte keine Zuordnung einer Therapieform zu einer Gruppe,
so daß sich die Effekte der Therapien möglicherweise überlagert haben.
Aufgrund der Mängel der Studien bezüglich Studiendesign, der
Anzahl der Kontrollgruppen, der Bestimmung der Parameter und
der Durchführung der einzelnen Maßnahmen (vor allem zu kurze
Applikationszeiten), können die Ergebnisse nicht für eine Beurteilung des therapeutischen Effektes einer Iontophorese mit
einem NSA gegenüber anderen Applikationsformen des Medikamentes oder anderen Iontophoreseformen herangezogen
7. Form, Inhalt und Aufbau einer Studie zur Untersuchung
der analgetischen Wirksamkeit einer Iontophorese mit
Voltaren® Emulgel® bei Zustand nach einer lumbalen
Bandscheibenoperation
Die Untersuchung der oben zitierten Studien zeigte, daß sie
aufgrund der aufgeführten Mängel nicht allgemeinen wissenschaftlichen Anforderungen genügen (vgl. Kunz et al. 2000,
123, 126, 127, 128f). Deshalb sind sie für praktische Fragen oder bei der Suche nach Entscheidungshilfen für oder gegen die
Durchführung einer Iontophorese mit einem NSA nach einer
lumbalen Bandscheibenoperation nur begrenzt nutzbar, denn eine aussagekräftige Studie sollte folgende Kriterien erfüllen:
1. Sie muß randomisiert sein.
Eine Randomisierung erhöht die Wahrscheinlichkeit, daß die
Voraussetzungen, die jeder einzelne Proband mitbringt (z.B. körperlich, geistig, gesundheitlich und sozial), gleichmäßig auf
alle Gruppen verteilt werden, denn
„By keeping the groups as similar as possible at the start of the
study, the investigators will be more able to isolate and quantify the impact of the interventions that they are studying,
with minimal effects from other factors that could influence the course of the study participants." (Jadad 2000, 3)
2. Es sollten möglichst alle Teilnehmer– soweit dies möglich ist –
verblindet, also unwissend gegenüber der durchgeführten Maßnahme sein.
Die Verblindung ist notwendig, um zu verhindern, daß
subjektive Erwartungen verschiedenster Teilnehmer (z.B. Patient, Therapeut, Statistiker) an die durchgeführte Maßnahme
in die Beurteilung der Parameter oder der Ergebnisse mit einfließen.
3. Es müssen Kontrollgruppen eingeführt werden, um möglichst
auszuschließen, daß es sich bei dem Erfolg, der durch die
untersuchte Maßnahme (Iontophorese mit einem NSA) eintritt, um einen Plazeboeffekt handelt oder von anderen
Einflußfaktoren (z.B. nur durch den galvanischen Strom)
bestimmt wird. Folgende Kontrollgruppen sind notwendig:
- Iontophorese mit Plazebo
- Scheinstrom mit Voltaren® Emulgel®
- Scheinstrom mit Plazebo
- eine Gruppe ohne Therapie
4. Im Vorfeld der Durchführung der Studie muß außerdem die
Gruppengröße berechnet werden. Die Studienpopulation muß
groß genug sein, damit eine große Wahrscheinlichkeit besteht,
statistisch signifikante positive Wirkungen zu entdecken, wenn es sie denn gibt. Nur so kann man ziemlich sicher sein, daß kein
Nutzen existiert, der nicht in der Studie aufgedeckt worden wäre (vgl. Greenhalgh 2000, 86; Altman 1991, 456).
Um die Gruppengröße zu berechnen, muß folgendes entschieden werden:
- Wie groß muß der Unterschied in der Größe der Parameter
sein, damit es sich um eine klinisch signifikante Wirkung
handelt (vgl. Greenhalgh 2000, 86)?
- Wie groß sind Durchschnitt und Standardabweichung der
wichtigsten Parameter (vgl. ebenda)?
5. Durch die geplante Studie sollen folgende Fragen beantwortet
- Lindert die Iontophorese mit Voltaren® Emulgel® bei einer
festgelegten Anzahl von Patienten mit Schmerzen nach einer
mikrochirurgischen Bandscheibenoperation die Schmerzen signifikant mehr als eine Anwendung mit Plazebo und Strom,
Plazebo und Scheinstrom oder Voltaren® Emulgel® mit Scheinstrom?
- Wird die Beweglichkeit im Alltag (Aufstehen, Hinsetzen,
Hinstellen, Bücken) durch diese Anwendungsform bei einer
entsprechenden Anzahl von Patienten signifikant mehr verbessert als durch die vier anderen?
- Kann der orale Analgetikabedarf durch eine
Iontophoreseserie mit Voltaren® Emulgel® signifikant mehr verringert werden als in den Kontrollgruppen?
8. Behandlungsparameter für die Durchführung einer
analgetisch wirksamen Iontophorese mit einem
nichtsteroidalen Antiphlogistikum
Aus dem sechsten Kapitel lassen sich für eine Iontophorese, die
analgetisch wirksam sein soll folgende Parameter aufstellen:
1. Der Wirkstoff Diclofenac muß unter Kathode appliziert werden,
weil es ein Anion ist (vgl. Bremerich/Wiegel 1988, 842).
2. Die Applikationsfläche sollte so groß wie möglich gewählt
werden, denn nach dem Fick'schen Diffusionsgesetz ist die Menge des diffundierten Stoffes um so größer, je größer die
Austauschfläche ist. Außerdem konnten Riess et al. (1986) zeigen, das die Plasmaspiegel des Wirkstoffes proportional zur
Dosis verlaufen (vgl. derselbe 1986, 1093).
Eine höhere Dosis kann durch Vergrößerung der Applikationsfläche, aber auch durch Auftragen einer großen
Menge unter der Elektrode erreicht werden. Eine hohe Dosis vergrößert einerseits die Menge des
Wirkstoffes, die in die Haut, Muskulatur und Unterhaut gelangt.
Werden anderseits auch im Plasma therapeutisch wirksame Konzentrationen erreicht, kann der Wirkstoff über den
Blutkreislauf in weiter entfernt liegende bzw. entzündete Gewebe gelangen (z.B. in die durch den Bandscheibenvorfall
bzw. die Operation verletzten Gewebe).
3. Da die Messungen der Wirkstoffkonzentrationen in Plasma und
Urin von Pratzel (1985) zeigen, daß therapeutisch wirksame
Konzentrationen erst durch die Verdoppelung der Iontophoresezeit auf sechzig Minuten erreicht werden konnten,
sollte die Applikationsdauer in der Studie für alle Gruppen auch
möglichst hoch sein und dreißig Minuten überschreiten. Um die schädigenden Nebenwirkungen auf der Haut unter den
Elektroden durch die elektrolytischen Vorgänge möglichst gering halten und die Applikationszeit verlängern zu können,
gibt es folgende Möglichkeiten:
- Die Verwendung von Silberelektroden mit Chloridlösung:
Unter der Anode regiert das Silber mit dem Chlor zu Silberchlorid. Da diese Reaktion schon bei relativ geringen
Spannungen erfolgt, wird die Elektrolyse von Wasser verhindert
(vgl. Ashburn et al. 1992, 32, 33; Nair et al. 1999, 146; Singh/Singh 1993, 605).
- Sanderson et al. (1986) entwickelten Elektroden, die zwei
räumlich voneinander durch eine Membran getrennte Kammern
enthalten. Die obere Kammer enthält einen Phosphatpuffer, die
untere das Medikament. Die Membran läßt den Austausch von Anionen zu, die untere Kammer ist durch eine mikroporige
Polypropylenmembran abgeschlossen (vgl. derselbe 216).
4. Die Anwendung sollte mindestens fünf Tage lang erfolgen
(wenn möglich länger) um hohe Plasma- und Gewebekonzentrationen zu erreichen (vgl. Pratzel 1985, 34).
5. Der Strom sollte mindestens mit einer Intensität von 0,1
mA/cm2 fließen (vgl. Pratzel et al. 1986, 77; Pratzel 1985, 27).
9. Parameter zur Bestimmung der Wirkung physikalisch-
pharmakologischer Verfahren zur Schmerzhemmung
Die Untersuchung der Studien hat gezeigt, daß die Parameter zur Bestimmung der klinischen Wirkung physikalisch-
pharmakologischer Verfahren exakter bestimmt werden müssen.
Dabei sollte nicht nur eine Beurteilung der Schmerzhaftigkeit durch Schmerzmessungen erfolgen, sondern möglichst auch objektive,
meßbare Parameter mit herangezogen werden. Dazu gehören die Messung der Beweglichkeit nach der Neutral-0-Methode oder
Umfangsmessungen bei Schwellungen.
9.1. Schmerzmessung und Schmerzdokumentation
Schmerz ist schwer zu quantifizieren, da es sich um ein komplexes
psychophysisches Erlebnis handelt (vgl. Bieling 1995, 3). Trotzdem sind seit jeher Bestrebungen zu verzeichnen, den
Schmerz einer objektiven, reproduzierbaren Messung zugänglich zu machen, weil er als Indikator von Krankheits- und
Heilungsprozessen eine besondere Bedeutung hat. Ein
zuverlässiges Meßinstrument für den Schmerz sollte gewissen Mindestansprüchen genügen: Chapman et al. (1985) nannten in
diesem Zusammenhang:
1. Reliabilität: Das Verfahren produziert zu verschiedenen
Zeitpunkten unter objektiv gleichen Bedingungen das gleiche Ergebnis
2. Validität: das Verfahren mißt, was es zu messen vorgibt 3. Flexible und einfache Handhabung des Verfahrens (vgl.
Chapman et al. 1985, 1; Lehmann 1994, 51)
Das subjektive Schmerzempfinden wird mit Hilfe kategorieller (mit
Adjektiven arbeitender) Schmerzskalen oder visueller Analogskalen gemessen. Eine weitere, komplexere Methode stellt das McGill Pain
Questionnaire (MPQ) dar (vgl. Lehmann 1994, 60).
Die Schmerzmessung steht auch zur Bestimmung der Wirksamkeit
einer Iontophorese mit Diclofenac bezüglich der Schmerzverringerung nach einer mikrochirurgischen
Bandscheibenoperation in der Lendenwirbelsäule im Vordergrund.
Denn die anderen, oben erwähnten Parameter wie Umfangsmessungen zur Bestimmung von Schwellungszuständen
oder Messung der endgradigen Beweglichkeit, sind aufgrund fehlender großer Schwellungszustände nicht möglich und aufgrund
des postoperativen Behandlungszieles der Stabilität des
Operationsgebietes nicht erlaubt (vgl. Frank et al. 1994, 456).
9.1.1. Kategorielle Schmerzskalen
Bei kategoriellen Schmerzskalen wird der Patient gebeten, sein gegenwärtiges Schmerzempfinden oder das nach einer Behandlung
bzw. Behandlungsserie einer begrenzten Zahl von Begriffen zuzuordnen. Im klinischen Alltag werden in der Regel Fünf-Stufen-
Skalen verwendet (vgl. Bieling 1995, 6).
Bei der Auswertung werden in der Regel die einzelnen Stufen in
Zahlenwerte umgerechnet, was das Problem mit sich führt, daß die Begriffe auf der Fünf-Stufen-Skala so zueinander gesetzt werden,
als wären sie gleichmäßig voneinander entfernt und würden die gleichen Spannweiten abdecken. Die Distanzen der einzelnen
Skalenpunkte zueinander sind jedoch überhaupt nicht festgelegt,
worin der Hauptmangel dieser Skala besteht (vgl. Clauß et al. 1995, 19).
Außerdem muß bei diesem Verfahren berücksichtigt werden, daß die einzelnen Probanden die verwendeten Begriffe unterschiedlich
auffassen und bewerten können (vgl. Bieling 1995, 7).
9.1.2. Visuelle Analogskalen
Die Visuelle Analogskala (VAS) ermöglicht die Quantifizierung des
Schmerzes. Der Patient trägt entweder auf einem 100mm langen Strich, der die Pole „kein Schmerz" bzw. „unerträglicher Schmerz"
enthält, seine subjektiv empfundene Schmerzstärke ein. Oder er ordnet seinen Schmerz auf einer 100-Punkte-Skala einem
Punktwert zwischen 0 und 100 zu (vgl. Bieling 1995, 8).
9.1.3. McGill Pain Questionnaire (MPQ)
Dieser Schmerzfragebogen ermöglicht eine quantitative Beurteilung
des Schmerzes. Die aufgeführten Begriffe beschreiben drei Dimensionen des Schmerzes:
- eine sensorische Dimension
- eine affektive Dimension
- eine evaluative Dimension
Der Fragebogen besteht aus 78 Deskriptoren, die auf 20 Gruppen
aufgeteilt sind und die verschiedene Qualitäten des Schmerzes beschreiben. Aus den verschiedenen Begriffen, die der Patient oder
die Patientin zur Schmerzbeschreibung gewählt hat, wird ein „pain
rating index" bestimmt, in welchem das Wort einer Subklasse, das den geringsten Schmerz ausdrückt, einen Wert von „eins" zugeteilt
bekommt und das nächste einen Wert von „zwei" usw. (vgl. Melzack/Katz 1994, 340). Weiterhin werden die Worte gezählt, die
gewählt wurden, und schließlich wird die „Nummer-Wort-
Kombination" bestimmt, die die gesamte Schmerzintensität anzeigt (vgl. ebenda).
Das MPQ ist in erster Linie für Patienten mit chronischen Schmerzen geeignet, wo die Schmerzstärke kein ausreichendes
Kriterium ist (vgl. Bieling 1995, 8).
Der Nachteil dieses Schmerzfragebogens ist, daß er sehr komplex
und nicht einfach zu handhaben ist, und es zu Fehlern bei der Auswertung kommen kann: Holroyd et al. (1992) zeigten, daß die
Validität der Auswertungsverfahren, vor allem des „pain rating
index", sehr zweifelhaft ist (vgl. derselbe 301).
Für die geplante Studie würde sich zur Beurteilung des subjektiven Schmerzempfindens bzw. der Schmerzstärke aufgrund der
einfachen Handhabung und aufgrund der Tatsache, daß die
Patienten nach einer Bandscheibenoperation in der Regel akute Schmerzen haben, die Visuelle Analogskala eignen.
Ein weiterer Parameter zur Bestimmung der klinischen Wirksamkeit
der Iontophorese wäre die Beurteilung der „Funktion", d.h. die
Bestimmung der Möglichkeit der Durchführung alltäglicher
Bewegungsabläufe wie das Drehen aus der Rücken- in die Seitlage, das Hochkommen zum Sitz, das Aufstehen, das Stehen, das
Gehen, das Treppe steigen, das Bücken und weitere Tätigkeiten.
10. Diskussion
Aus den erarbeiteten Ergebnissen bezüglich der
Behandlungsparameter für eine analgetisch wirksame Iontophorese
und der Methodik für eine Studie, die diese analgetische Wirksamkeit nachweisen soll, ergeben sich einige Schwierigkeiten
bezüglich der Praktikabilität und Wertigkeit:
1. Eine einstündige iontophoretische Applikation ist zu lang, um
sie im klinischen Alltag durchführen zu können. Eine orale Gabe führt schneller und mit geringem Aufwand zu gesicherten
therapeutischen Plasmakonzentrationen.
2. Eine Studie, die neben Schmerzmessungen noch weitere
Parameter für den Nachweis der Wirksamkeit einer therapeutischen Maßnahme bestimmen kann, ist wesentlich
aussagekräftiger. Deshalb würden sich Patienten mit Sprunggelenks- oder Knieverletzungen besser eignen, weil dort
auch Umfangsmessungen und Messungen der Beweglichkeit
nach der Neutral-0-Methode durchgeführt werden könnten.
11. Zusammenfassung
Die komplexe Schmerzsymptomatik nach einer mikrochirurgischen
Bandscheibenoperation ist Folge der verschiedenen an der Schmerzentstehung möglicherweise beteiligten Strukturen. Dazu
1. die Haut, Faszien und Gefäße, die durch den chirurgischen
Schnitt verletzt und zum Teil wieder genäht wurden.
2. die entzündete Nervenwurzel
3. das Lig. longitudinale posterius, das durch das prolabierte
Bandscheibengewebe in seiner Länger verändert worden sein kann oder sogar durchbrochen wurde
4. das Periost der Wirbelbogenwurzel, das durch den Zug des
Ligamentum gereizt worden sein kann
5. die Grund- bzw. Deckplatte der Wirbelkörper
6. die Gelenkkapsel der Facettengelenke 7. die umliegende Muskulatur
8. das Viszerotom
Die iontophoretische Applikation von Voltaren® Emulgel® zur
postoperativen Schmerzlinderung ist nur dann sinnvoll, wenn sie mehr als dreißig Minuten durchgeführt und die Applikationsfläche
so groß wie möglich gewählt wird. Dadurch kann einerseits die in die Haut gelangende Wirkstoffrate erhöht werden. Andererseits
gelangt so der Wirkstoff auch in den Blutkreislauf, wodurch eine
systemische Verteilung erfolgen kann. Diese wiederum ist Voraussetzung dafür, daß auch die unter der Haut liegenden und
an der Schmerzentstehung beteiligten Strukturen von dem Wirkstoff erreicht werden.
Die Applikationsdauer wird jedoch vor allem durch die
elektrolytischen Vorgänge in der Haut unter den üblicherweise verwendeten Metallelektroden begrenzt. Silberelektroden oder
Elektroden, die einen Puffer enthalten, können die Applikationszeiten erheblich verlängern.
Werden therapeutisch wirksame Wirkstoffkonzentrationen in einem entzündeten Gewebegebiet erreicht, ist es möglich, daß die
entzündliche Phase der Wundheilung beeinflußt wird. Deshalb ist bei der Anwendung zu berücksichtigen, daß die Salbe entfernt von
der Narbe aufgetragen wird. Ob indirekt über die systemische
Verteilung von Diclofenac wundheilungsstörende Konzentrationen im Narbenbereich erreicht werden könnten, kann im Augenblick
nicht vorhergesagt werden.
Eine klinische Studie, die nachweisen soll, ob postoperative
Schmerzen durch eine Iontophorese mit Voltaren® Emulgel® signifikant gelindert werden können, muß mit mindesten vier
Kontrollgruppen (Medikament und Scheinstrom, Plazebo und Strom, Plazebo und Scheinstrom und eine Gruppe ohne Therapie),
blind und randomisiert durchgeführt werden.
LITERATURVERZEICHNIS
ASHBURN, M.A./STEPHEN, R.L./ACKERMAN, E., PETELENZ,
T.J./HARE, B./PACE, N.L./HOFMAN, A.A.: Iontophoretic delivery of
morphine für postoperative analgesia. In: J pain Symptom Manage,
1992, 7(1), S. 27-33.
ALTMAN, D.: Practical statistics for medical research. London 1991.
BarCharts, Inc.®: Anatomy. The Most Comprehensive All-In One
Anatomy Chart. Boca Raton 1998.
BARRY, B.W. (1987): Penetration enhancers. In: SHROOT,
B./SCHAEFER, H. (Hrsg.): Skin Pharmacokinetics. Basel 1987, S.
BAUER, K.H./FRÖMMING, K.H./FÜHRER, K. (Hrsg.):
Pharmazeutische Technologie. Stuttgart 1999.
van den BERG, F. (1994): Bandscheibe spezial. In: LASER, T.
(Hrsg.): Lumbale Bandscheibenleiden. Bern/Wien/New York 1994,
BIELING, A.: Validierung verbaler Schmerzskalen. Dissertation.
BREMERICH, A./WIEGEL, W.: Kombinationstherapie von
Transkutaner Elektrischer Nervenstimulation und Iontophorese mit
Benzydamin und Diclofenac. In: Drug Res 1988; 38(1), S. 842-
BROKMEIER, A.A.: Manuelle Therapie. Stuttgart 1996.
BRUNE, K./DIETZEL, K./MÖLLER, N.(1986): Pharmakologie des
Schmerzes. In: WÖRTZ, R. (Hrsg.): Pharmakotherapie bei
Schmerzen. Weinheim 1986, S. 45-93.
BROWN, M.F./HUKKANEN, M.V./McCARTHY, I.D./REDFERN, D.R./
BATTEN, J.J./ CROCK, H.V./HUGHES, S.P./POLAK, J.M.: Sensory
and sympathetic innervation of the vertebral endplates in patients
with degenerative disc disease. In: J Bone Joint Surg Br 1997;
79(1), S. 147-153.
CHAPMAN, C.R./CASEY, K.L./DUBNER, R./FOLEY, K.M./GRACELEY,
R.H./READING, A.E.: Pain Measurement: An Overview. In: Pain
1985; 22(1), S. 1-31.
CLAUSS, G./FINZE, F.-R./PARTSCH, L.: Statistik. Frankfurt 1995.
DEBRUNNER, A.M.: Orthopädie/orthopädische Chirurgie.
Göttingen/Toronto/Seattle 1995.
DIWAN, P.V./KULKARNI, D.R.: Effects of Nonsteroidal
Antiinflammatory Agents (NSAIAs) on Wound Healing. In: Indian J
Exp Biol 1986; 24(10), S. 640-643.
DEMIRTAS, R.N./ONER, C: The treatment of lateral epicondylitis by
iontophoresis of sodium salicylate and sodium diclofenac. In: Clin
Rehabil 1998, 12(1), S. 23-29.
DUDEL, J. (2000): Informationsvermittlung durch elektrische
Erregung. In: SCHMIDT, R./THEWS, G. (Hrsg.): Physiologie des
Menschen. Berlin/Heidelberg/New York 2000, S.20-42.
DVIVEDI, S./TIWARI, S.M./SHARMA, A.: Effect of ibuprofen and
diclofenac sodium on experimental wound healing. In: Indian J Exp
Biol 1997; 35(11), S. 1243-1245.
ENGEL, J.M./STRÖBEL, G.: Rheumatherapie. Weinheim 1990.
FENNER, H.: Transsynovialkinetik und Dosis-Wirkungs-Korrelation
bei nicht-steroidalen Antirheumatika. Fortschr Med 1982; 100(36),
FRANK, A./MANKEL, A./WOLF, U./KOLSTER, B./WILKE, A. (1994):
Der Patient in der Orthopädie. In: Leitfaden Physiotherapie.
Stuttgart 1994, s. 350-464.
FRITSCH, P. (1985): Die Haut. In: FLEISCHHAUER,
K./STAUBESAND, J./ZENKER, W. (Hrsg.): Benninghoff.
Makroskopische und mikroskopische Anatomie des Menschen. Band
3. München/Wien/Baltimore 1985, S. 565- 586.
FRUHSTORFER, H. (1994): Nozizeption und postoperativer
Schmerz. In: LEHMANN, K.A. (Hrsg.): Der postoperative Schmerz.
Berlin/Heidelberg 1994. S. 37-48.
GIERTZ, H./FLOHE, L./PESKAR, B.A./RESCH, K. (1992): Mediatoren
der Entzündung und Allergie. In: FORTH, W./HENSCHLER,
D./RUMMEL, W./STARKE, K. (Hrsg.): Pharmakologie und
Toxikologie. Mannheim/Leipzig 1992, S. 304-344.
GIERTZ, H./FLOHE, L./GOETHERT, M./PESKAR, B.A./RESCH, K.
(1996): Mediatoren der Entzündung und Allergie.
Pharmakotherapie der Allergie; Arzneimittelallergie. In: FORTH,
W./HENSCHLER, D./RUMMEL, W./STARKE, K. (Hrsg.): Allgemeine
und Spezielle Pharmakologie und Toxikologie. Mannheim/Leipzig
1996, S. 319-362.
GREENHALGH, T.: Einführung in die Evidence-based Medicine. Bern
GRONWALD, U.: Wirkstoffkonzentrationen in articulären und
periartikulären Geweben des Kniegelenks nach kutaner Anwendung
von Diclofenac Diethylammonium. Dissertation. Ulm 1994.
GRUBEL, G./SCHRÖDER, F. (1999): Gehirn, Rückenmark, periphere
Nerven. In: SCHUMPELICK, V./BLEESE, N.M./MOMMSEN, U.:
Chirurgie. Stuttgart 1999, S. 491-541.
HACKENTHAL, E. (1999): Antirheumatika und Myotonolytika. In:
OBERDISSE, E./ HACKENTHAL, E./ KUSCHINSKY, K. (Hrsg.):
Pharmakologie und Toxikologie. Berlin/Heidelberg/New York 1999,
HANDWERKER, H.O./IGGO, A./ZIMMERMANN, M.: Segmental and
supraspinal actions on dorsal horn neurons responding to noxious
and non-noxious skin stimuli. In: Paion 1975; 1, S. 147-165.
HANDWERKER, H.O. (1998): Nozizeption und Schmerz. In:
SCHMIDT, R.F. (Hrsg.): Neuro- und Sinnesphysiologie.
Berlin/Heidelberg 1998, S. 249-261.
HOFFMANN LA ROCHE AG/URBAN & SCHWARZENBERG: Roche
Lexikon Medizin. München/Wien/Baltimore 1999.
HOLM, S./MAROUDAS, A./URBAN, J.P.G./SELSTAM,
G./NACHEMSON, A.(1981): Nutrition of the intervertebral disc:
solute transport and metabolism. In: Conn Tiss Res 1981; 8(2), S.
HOLM, S. (1993): Pathophysiology of disc degeneration. In:
STRÖMQVIST, B. (Hrsg.): The degenerative lumbar spine. Acta
Orthop Scand Suppl No 251, Vol 64. Kopenhagen 1993, S. 13-15.
HOLROYD, K.A./HOLM, J.E./KEEFE, F.J./TURNER, J.A./BRADLEY,
L.A./MURPHY, W.D./JOHNSON, W.D./ANDERSON, K./HINKLE,
A./O MALLEY, W.B.: A multi-center evaluation of the Mc Gill Pain
Questionnaire: results from more than 1700 patients. In: Pain
1992; 48(3), S. 301-311.
IASP: Pain terms: a list with definitions and notes on usage.
Recommended by the IASP Subcommitee on Taxonomy. In: Pain
1979; 6(3), S. 249-252.
ILLES, P./JURNA, J./KAEVER, V./RESCH, K. (1996): Analgetika und
Antiphlogistika. Schmerzbekämpfung und antirheumatische
Therapie. In: FORTH, W./HENSCHLER, D./RUMMEL, W./STARKE, K.
(Hrsg.): Allgemeine und Spezielle Pharmakologie und Toxikologie.
Mannheim/Leipzig 1996, S. 201-225.
IRVIN, T.T. (1990): Heilende Wunden. In: BAUKNECHT,
K.J./BUCKNALL, T.E./ELLIS, H./GERMER, C. (Hrsg.): Postoperative
Wundheilung von Organen und Organsystemen. Berlin 1990, S. 3-
JURNA, I. (1992): Analgetika. Schmerzbekämpfung. In: FORTH,
W./ HENSCHLER, D./ RUMMEL, W./STARKE, K. (Hrsg.):
Pharmakologie und Toxikologie. Mannheim/Leipzig 1992, S.200-
JADAD, A.R.: Randomised controlled trials: a user's guide. London.
KAHLE, W.: Nervensystem und Sinnesorgane. Taschenatlas der
Anatomie. Band 3. Stuttgart/New York 1991.
KARGER, T.I.: Die in vitro-Freisetzung von Eicosanoiden aus
Synovialgewebe, Knorpel und Knochen von Arthrosepatienten nach
in vivo Gabe von Diclofenac in oraler, rektaler und topischer
Applikationsform. Dissertation. Bochum 1992.
KARZEL, K./LIEDTKE, R.K.: Mechanismen transkutaner Resorption.
In: Arzneimittelforschung 1989; 39(2), S. 1487-1491.
KIOMARS, K.: Electrolyte Structures and Ionisation Conditions for
Iontophoretic Drug Formulation of Lokal Anaesthetics. Uppsala
KONTTINEN, Y.T./GRÖNBLAD, M./ANNTI-POIKA, I./SEITSALO,
S./SANTAVIRTA, S./HUKKANEN, M./POLAK, J.M.:
Neuroimmunhistochemical analysis of peridiscal nociceptive neural
elements. In: Spine 1990; 15(5), S. 383-386.
KLINKE, R. (2001): Bauelemente des Nervensystems. In: KLINKE,
R./SILBERNAGL, S. (Hrsg.): Lehrbuch der Physiologie.
Stuttgart/New York 2001, S. 539-576.
KRÄMER, J.: Bandscheibenbedingte Erkrankungen. Stuttgart/New
KRÄMER, J.: Natural Course and Prognosis of Intervertebral Disc
Diseases. In: Spine 1995; 20(6), S. 635-639.
KRÄMER, J.: Orthopädie. Berlin/Heidelberg/New York 1996.
KRIWET, K.: Diclofenac-Diethylamin und seine Assoziate mit
Phospholipiden: Charakterisierung der Systeme und Einfluß auf
Struktur und Permeabilität humanen Stratum corneums.
Dissertation. Braunschweig 1994.
KUNZ, R./FRITSCHE, L./NEUMAYER, H.-H. (2000): Kritische
Bewertung von präventiven oder therapeutischen Interventionen.
In: KUNZ, R. (Hrsg.) Lehrbuch evidenzbasierte Medizin in Klinik
und Praxis. Köln 2000, S.120-135.
LEHMANN, K.A. (1994): Schmerzmessung und -dokumentation. In:
LEHMANN, K.A. (Hrsg.): Der postoperative Schmerz.
Berlin/Heidelberg 1994, S.49-74.
LEONHARDT, H. (1991): Innere Organe. Taschenatlas der
Anatomie. Band 2. Stuttgart/New York 1991.
LOTH, H.: Skin permeability. In: Meth Find Exp Clin Pharmakol
1989; 11(3), S. 155-164.
McLATCHIE, G.R.: Oxford Handbook of Clinical Surgery. Oxford
MEYERS LEXIKONREDAKTION (Hrsg.): Schülerduden. Die Chemie.
Mannheim/Leipzig/Wien/Zürich 1988.
MELTZACK, R./KATZ, J. (1994): Pain measurement in persons in
pain. In: WALL, P.D./MELTZACK, R. (Hrsg.): Textbook of pain.
London/New York/Tokyo 1994, S. 337-351.
NAIR, V./PILLAI, O./PODURI, R./PANCHAGNULA, R.: Transdermal
Iontophoresis. Part I: Basic Principles and Considerations. In: Meth
Find Clin Pharmacol 1999, 21(2), S. 139-151.
PAPAVERO, L./CASPAR; W. (1993): The lumbar microdiscectomy.
In: STRÖMQVIST, B. (Hrsg.): The degenerative lumbar spine. Acta
orthop Scand Suppl No 251, Vol 64. Kopenhagen 1993, S.34-37.
PAVELKA, K. Jun./PAVELKA, K. Sen./SVARKOVA, J./VACHA,
J./TRNAVSKY, K.: Kann man die analgetische Wirkung der
Mobilisin-Salbe durch die Iontophorese verstärken?
Placebokontrollierte Dreifach-cross-over-Doppelblindstudie. In: Z
Rheumatol 1988; 47(4), S. 233-237.
PLATZER, W.: Bewegungsapparat. In: KAHLE, W./LEONHARDT,
H./PLATZER, W. (Hrsg.): Taschenatlas der Anatomie. Band 1.
Stuttgart/New York 1991.
POSTACCHINI, F./CARUSO, I./SARACENI, V.M. (1998):
Conservative treatments. In: POSTACCHINI, F. (Hrsg.): Lumbar
Disc Herniation. Wien/New York 1998. S. 341-376.
POTTS, R.O./FRANCOEUR, M.L.: The influence of stratum corneum
morphology on water permeability. In: J Invest Dermatol 1991;
PRATZEL, H.G.: Iontophorese. München 1985.
PRATZEL, H.G./MACHENS, R./DITTRICH, P.: Iontophorese zur
forcierten Hautresorption von Indometacin und Salicylsäure. In: Z
Rheumatol 1986; 45(2), S. 74-78.
PRATZEL, H.G.: Möglichkeiten der transkutanen medikamentösen
Therapie in der Physikalischen Therapie bei Muskelschmerzen. In:
Krankenhausarzt 1987; 60(1), S. 23-30.
PUTZ, R. (1985): Makroskopische Anatomie des
Bewegungsapparates. Wirbelsäule, Columna vertebralis. In:
FLEISCHHAUER, K./STAUBESAND, J./ZENKER, W. (Hrsg.):
Benninghoff. Makroskopische und mikroskopische Anatomie des
Menschen. Band 1. München/Wien/Baltimore 1985, S. 253-282.
RADERMACHER, J./JENTSCH, D./SCHOLL, M.A./LUSTINETZ, T.
/FRÖLICH, J.C.: Diclofenac concentrations in synovial fluid and
plasma after cutaneous application in inflammatory and
degenerative joint desease. In: Br J Clin Pharmac (1991), 31(5), S.
RIEDE, U.-N. (1995): Entzündungspathologie. In: RIEDE, U.-
N./SCHAEFER, H.-E. (Hrsg.): Allgemeine und spezielle Pathologie.
Stuttgart/New York 1995, S. 207-247.
RIESS, W./SCHMID, K./BOTTA, L./KOBAYASHI, K./MOPPERT,
J./SCHNEIDER, W./ SIOUFI, A./STRUSBERG, A./TOMASIT, M.: Die
perkutane Resorption von Diclofenac. In: Arzneimittelforschung
1986; 36(7), S. 1092-1096.
RITSCHEL, W.A./HUSSAIN, A.S.: The principles of permeation of
substances across the skin. In: Meth Find Exp Clin Pharmacol
1988; 10(1), S. 39-56.
ROUGIER, A./DUPIUS, D./LOTTE, C./ROGUET, R./WESTER,
R.C./MAIBACH, H.I.: Regional variation in percutaneous absorption
in man: measurement by the stripping method. In: Arch Dermatol
Res 1986; 278(6), S. 465-469.
ROUGIER, A./RALLIS, M./KRIEN, P/LOTTE, C.: In vivo
percutaneous absorption: a key role for stratum corneum/ vehicle
partitioning. In: Arch Dermatol Res 1990; 282(8), S. 498-505.
SCHÄFER, S.: Messung der Tiefenpenetration von Diclofenac mit
Hilfe der Mikrodialysetechnik. Dissertation. Freiburg 1997.
SCHEUPLEIN, R.J.: Mechanism of percutaneous absorption. In: J
Invest Dermatol 1967; 48(1), S. 79-88.
SCHMIDT, R.F./SCHAIBLE, H.-G. (2000): Nozizeption und Schmerz.
In: SCHMIDT, R.F./THEWS, G./LANG, F. (Hrsg.): Physiologie des
Menschen. Berlin/Heidelberg/New York 2000, S. 236-250.
SCHÖFFLING-KRAUSE, U.: Arzneiformenlehre. Stuttgart 1998.
SCHUHFRIED, O./FIALKA-MOSER, V.: Iontophorese zur Behandlung
von Schmerzzuständen. In: Wien Med Wochenschr 1995; 145(1),
SCHWISTER, K. (Hrsg.): Taschenbuch der Chemie. Leipzig 1996.
SEDLARIK, K.M. (1993): Faktoren, die die Wundheilung
beeinflussen. In: SEDLARIK, K.M. (Hrsg.): Wundheilung.
Jena/Stuttgart 1993, S. 121-161.
SEDLARIK, K.M./AUDRING, H. (1993): Primäre und sekundäre
Wundheilung. In: SEDLARIK, K.M. (Hrsg.): Wundheilung.
Jena/Stuttgart 1993, S. 69-101.
SEDLARIK, K.M./KLÖCKING, H.-P. (1993): Hämostase und
Fibrinolyse bei der Wundheilung. In: SEDLARIK, K.M. (Hrsg.):
Wundheilung. Jena/Stuttgart 1993, S. 61-69.
SENN, E.: Elektrotherapie. Stuttgart/New York 1990.
STEUERNAGEL, K.: Iontophorese. In: Krankengymnastik 1995;
47(8), S. 1124-1128.
SILBERNAGL, S./DESPOPOULOS, A.: Taschenatlas der Physiologie.
SING, S./SINGH, J.: Transdermal drug delivery by passive diffusion
and iontophoresis: a review. In: Med Res Rev 1993; 13(5), S. 569-
SINOWATZ, F. (1996): Zellphysiologie. In: JELKMANN,
W./SINOWATZ, F.: Physiologie. Köln 1996, S. 11-50.
SMITH, W.P./CHRISTENSEN, M.S./ NACHT, S./GANS, E.H.: Effect
of lipids on the aggregation and permeability of human stratum
corneum. In: J Invest Dermatol 1982; 78(1), S. 7-11.
STEUERNAGEL, O. (1992): Physikalisch-chemische Grundlagen,
Impulse, Stromformen. In: STEUERNAGEL, O.: Skripten zur
Elektrotherapie. Band 1. Boppart 1992.
STURGE, R.A./YATES, D.B./GORDON, D./FRANCO, M./PAUL,
W./BRAY, A./ MORLEY, J.: Prostaglandin production in arthritis. In:
Ann Rheum Dis 1978; 37(4), S. 315-320.
STÜTTGEN, G./TÄUBER, U./BAUER, E./ZESCH, A.: Die lokale und
transkutane Pharmakotherapie. Pharmakologische Grundlagen und
klinische Bewertung. In: Hautarzt 1986; 37(2), S. 65-76.
TAKAHASHI, K./TAMAGAWA, S./KATAGI, T./KAMADA, A./RYTTING,
H./NISHIHATA, T./MIZUNO, N.: In vitro percutaneous transport of
sodium diclofenac and diclofenac from oleaginous vehicle. In:
Chem Pharm Bull 1991; 39(2), S. 509-511.
TÖNDURY, G.: Entwicklungsgeschichte und Fehlbildungen der
Wirbelsäule. Die Wirbelsäule in Forschung und Praxis. Band 7.
VECCHINI, L./GROSSI, E.: Ionisation with Diclifenac Sodium in
Rheumatic Disorders: A Double-blind Placebo-Controlled Trial. In: J
Int Med Res 1984; 12(6), S. 346-350.
WEBER, U. (1993): Wirbelsäuleneingriffe. In: WEBER,
U./GREULICH, M./SPARMANN, M. (Hrsg.): Orthopädische
Mikrochirurgie. Stuttgart/New York 1993, S. 287-311.
WEGNER-KEMPF, E.: Mittelfristige Ergebnisse der
Mikrochirurgischen Bandscheibenoperation - Prädiktierbarkeit und
therapeutische Beeinflußbarkeit durch Diclofenac-Natrium.
Dissertation. Marburg 1988.
WIECHERS, J.W.: The barrier function of the skin in relation to
percutaneous absorption of drugs. In: Pharm Weekbl Sci 1989;
11(6), S.185-198.
WINKELTAU, G./SCHUMPELICK, V.: Wunde, Wundheilung und
Wundbehandlung. In: SCHUMPELICK, V./BLEESE, N.M./MOMMSEN,
U.: Chirurgie. Stuttgart 1999, S. 37-60.
ZENKER, W. (1985): Makroskopische Anatomie des Rückenmarks
(Medulla spinalis) und der Spinalnervenwurzeln - Segmentlehre.
In: FLEISCHHAUER, K./STAUBESAND, J./ZENKER, W. (Hrsg.):
Benninghoff. Makroskopische und mikroskopische Anatomie des
Menschen. Band 3. München/Wien/Baltimore 1985, S. 105-115.
ZETKIN, M./SCHALDACH, H.: Wörterbuch der Medizin. Berlin 1992.
ZIMMERMANN, M. (1990): Das somatoviscerale sensorische
System. In: SCHMIDT, R.F./THEWS, G. (Hrsg.): Physiologie des
Menschen. Berlin/Heidelberg/New York 1990, S. 207-233.
ZIMMERMANN, M. (2000): Das somatoviscerale sensorische
System. In: SCHMIDT, R.F./THEWS, G./LANG, F. (Hrsg.):
Physiologie des Menschen. Berlin/Heidelberg/New York 2000, S.
Ich versichere an Eides statt, daß ich die vorliegende Arbeit selbständig und ohne Nutzung anderer als der angegebenen Hilfsmittel angefertigt habe. Alle Stellen, die wörtlich oder sinngemäß aus Veröffentlichungen entnommen sind, wurden als solche gekennzeichnet. Hamburg, Januar 2002 Franziska Fincke
Source: http://www.sportmedizin.uni-goettingen.de/downloads/abschlussarbeiten/ffincke.pdf
Peut-on éradiquer la teigne en élevage félin ? Les dermatophytoses ou dermatophyties ou « teignes » (lorsqu'il y a envahissement pilaire) sont des dermatoses dues à des champignons des genres Microsporum et Trichophyton. Bien que relativement peu fréquentes, les dermatophytoses sont préoccupantes car ce sont des zoonoses potentielles, pouvant se développer avec l'engouement croissant pour le chat et les nouveaux animaux de compagnie. Les signes cliniques de dermatophytie sont très polymorphes et ne se limitent pas à la lésion de « teigne » décrite classiquement (lésion nummulaire, alopécique et squamo-croûteuse d'évolution centrifuge lente, peu ou non prurigineuse). Après un recueil soigné de l'anamnèse et un examen clinique complet, une suspicion de teigne doit toujours être confirmée (ou infirmée) par un diagnostic expérimental rigoureux, reposant essentiellement sur quatre examens complémentaires (examen en lumière de Wood, examen direct, histopathologie et surtout culture mycologique). Le traitement en est, en effet, souvent difficile et il ne peut s'agir d'une thérapeutique à visée diagnostique. Les dermatophytoses peuvent guérir cliniquement spontanément chez le chat en 4 mois environ./Cela est lié au développement d'une réponse immune efficace. Cependant, le traitement est nécessaire pour des raisons d'éthiques évidentes et, également, pour prévenir une contagion humaine ou animale. LE TRAITEMENT DES DERMATOPHYTOSES La tonte est conseillée, quand elle est possible sur le plan pratique. Le traitement topique :
Jurnal Natur Indonesia 15(1), Februari 2013: 57–62 Synthesis and antimalarial activity 57 Synthesis and Antimalarial Activity of 2-Phenyl-1,10-Phenanthroline Derivative Compounds Ruslin Hadanu1*), Mustofa2), and Nazudin1) 1)Department of Chemistry, Faculty of Teachership and Educational Science, Pattimura University, Poka, Ambon 97233





