Tpe-ogm.fr
Toxicité à long terme d'un herbicide Roundup et d'un maïs modifié
génétiquement pour tolérer le Roundup
Gilles-Eric Séralini*, Emilie Clair, Robin Mesnage, Steeve Gress, Nicolas Defarge, Manuela Malatesta, Didier Hennequin, Joël Spiroux de Vendômois
*Correspondance à
Traduit en français par les auteurs.
Résumé : Nous avons étudié pendant 2 ans sur des rats les effets sanitaires d'un maïs transgénique tolérant à l'herbicide Roundup (introduit dans l'alimentation à 3 doses de 11, 22 et 33%), cultivé avec ou sans épandage de cet herbicide, ou bien de Roundup seul dans l'eau de boisson (à partir de 0,1 parties par milliard). Les femelles, dans tous les groupes traités, sont mortes 2 à 3 fois plus que dans le groupe-témoin, et plus rapidement. Cette différence a été observée dans 3 groupes de mâles nourris avec l'OGM. Tous les résultats obtenus sont hormono-dépendants et liés au sexe,, avec des profils pathologiques comparables dans presque tous les cas. Les femelles ont développé plus fréquemment de grosses tumeurs mammaires et avant le groupe témoin, l'hypophyse étant le second organe le plus touché ; l'équilibre hormonal a été modifié par les traitements à base d'OGM et de Roundup. Chez les mâles traités, les nécroses et congestions du foie étaient de 2,5 à 5,5 fois plus élevées. Cette pathologie a été confirmée macroscopiquement, et en microscopie optique et électronique. Les néphropathies rénales progressives chroniques marquées et sévères étaient généralement de 1,3 à 2,3 plus élevées. Les mâles présentaient jusqu'à 4 fois plus de grosses tumeurs palpables, qui apparaissaient jusqu'à 600 jours plus tôt que le groupe témoin. Les données biochimiques ont confirmé des déficiences chroniques significatives des reins ; pour tous les traitements et les deux sexes, 76% des altérations des paramètres physiologiques étaient liés aux reins. Ces résultats peuvent s'expliquer par les perturbations endocriniennes non linéaires (non proportionnelles à la dose) causées par le Roundup, ainsi que par la surexpression du transgène dans l'OGM, et ses conséquences métaboliques.
1. Introduction
Il y a un débat international en cours sur la durée nécessaire des études de toxicité sur
mammifères lors de la consommation de plantes génétiquement modifiées (GM) comportant des analyses métaboliques (Séralini et al., 2011). À l'heure actuelle, aucune instance de réglementation ne demande qu'une étude de toxicologie chronique (ou non) chez l'animal ne soit obligatoirement effectuée pour les OGM alimentaires et les pesticides formulés. Cependant, plusieurs études constituant à nourrir des rats pendant 90 jours ont été menées par l'industrie des biotechnologies. Pour la plupart, ces tests concernent du soja et du maïs qui sont soit tolérants aux herbicides
(Roundup (R) dans 80% des cas), ou conçus pour produire un insecticide modifié, la toxine Bt, ou les deux. En conséquence, ces cultures génétiquement modifiées contiennent des nouveaux résidus de pesticides pour lesquels de nouvelles Limites Maximales de Résidus (LMR) ont été établies dans certains pays.
Si les requérants concluent en général qu'il n'y a pas d'effet majeur après des études de
toxicité subchronique de l'organisme génétiquement modifié (OGM) (Domingo et Giné Bordonaba, 2011; Hammond et al, 2004, 2006a, b), des perturbations significatives ont été trouvées et peuvent être interprétées différemment (Séralini et al, 2009; Spiroux de Vendômois et al., 2010). Des analyses détaillées ont révélé des altérations des fonctions des reins et du foie qui peuvent être des signes de début d'intoxication alimentaire chronique, pouvant s'expliquer au moins en partie par les résidus de pesticides présents dans les aliments génétiquement modifiés (Séralini et al, 2007; Spiroux de Vendômois et al., 2009). En effet, il a été démontré que des concentrations de R de l'ordre de 103 fois inférieure à la LMR induisent des effets de perturbation endocrine dans les cellules humaines (Gasnier et al., 2009) et des effets toxiques à des doses supérieures (Benachour et Séralini, 2009), y compris in vivo (Romano et al., 2012). Après plusieurs mois de consommation d'un soja tolérant au Roundup, le foie et le pancréas de souris ont été touchés, montrant des perturbations de la structure interne des noyaux de leurs cellules (Malatesta et al., 2008a, 2002a, b). En outre, cet effet toxique a été reproduit par l'application de l'herbicide R directement sur des hépatocytes en culture (Malatesta et al., 2008b).
Depuis lors, des tests de toxicologie à long terme et multi-générationnels ont été menés
chez l'animal, dont certains semblent apporter des preuves d'innocuité, tandis que d'autres concluent sur la nécessité d'investigations complémentaires en raison des modifications métaboliques (Snell et al., 2011). Cependant, aucune de ces études n'a inclus un suivi détaillé des animaux utilisant jusqu'à 11 échantillons de sang et d'urine sur 2 ans, et aucune n'a étudié le maïs NK603 tolérant au R.
En outre, l'évaluation de la toxicité des herbicides est généralement effectuée sur la
physiologie des mammifères à travers une étude à long terme du seul principe actif, plutôt que de la formulation complète utilisée en l'agriculture, comme cela a été le cas pour le glyphosate (Williams et al., 2000), le principe actif de l'herbicide R. Il est important de noter que le glyphosate est capable de pénétrer plus efficacement les organismes végétaux cibles à l'aide d'adjuvants présents dans les différentes formulations de R utilisées dans le commerce (Cox, 2004). Lorsque des résidus R sont retrouvés dans l'eau du robinet, dans la nourriture humaine ou animale, ils proviennent de l'herbicide total en formulation, qui est le mélange le plus couramment utilisé en agriculture; en fait, de nombreux auteurs dans le domaine ont fortement insisté sur la nécessité d'étudier les effets toxiques potentiels des mélanges des produits chimiques plutôt que des composants simples (Cox et Surgan, 2006; Mesnage et al., 2010; Monosson, 2005). Même des adjuvants et pas seulement le glyphosate ou d'autres ingrédients actifs se retrouvent dans les eaux souterraines (Krogh et al., 2002), et donc une exposition à des dilutions de la formulation complète est plus représentative d'une pollution environnementale que l'exposition au glyphosate seul pour étudier les effets sur la santé.
En vue de remédier à ce manque d'information, nous avons effectué une étude détaillée de
toxicologie chronique de 2 ans chez le rat. La directive 408 actuelle de l'Organisation de coopération
et de développement économiques (OCDE) a été suivie par certains fabricants d'OGM, même si elle n'a pas été conçue à cette fin. Nous avons exploré plus de paramètres et plus fréquemment que recommandé dans la présente norme (Tableau 1) dans une expérience à long terme. Cela nous a permis de suivre en détail les effets potentiels sur la santé et leurs origines possibles attribuables aux conséquences directes ou indirectes de la modification génétique elle-même dans les OGM, ou à la formulation d'herbicide en mélange utilisée sur les OGM (et pas le glyphosate seul), ou aux deux. En raison de revues récentes sur les OGM (Domingo et Giné Bordonaba, 2011; Snell et al, 2011) nous n'avions aucune raison d'établir dans un premier temps un protocole de carcinogenèse en utilisant 50 rats par groupe. Cependant, nous avons prolongé les analyses biochimiques et hématologiques et appliqué le suivi médical recommandé dans les études chroniques combinées en utilisant 10 rats par groupe (jusqu'à 12 mois dans l'OCDE 453). Cela reste le plus grand nombre de rats régulièrement mesurés dans une étude standard de toxicologie sur un OGM. Nous avons également testé pour la première fois 3 doses (au lieu de 2 dans le protocole habituel à 90 jours) du maïs GM NK603 tolérant au R seul, du maïs transgénique traité avec R, et le R seul à de très faibles doses environnementales, ces dernières démarrant en dessous des niveaux autorisés par les autorités de réglementation dans l'eau de boisson et dans les aliments GM.
2. Matériels et méthodes
2.1. Ethique
Le protocole expérimental a été élaboré en conformité avec les règlements de l'éthique dans
le cadre d'une animalerie autorisée par le ministère français de l'Agriculture et de la Recherche (Agrément n° A35-288-1). Les expériences sur les animaux ont été effectuées conformément aux directives d'éthique des expérimentations animales (régulation CEE 86/609). En ce qui concerne les études sur le terrain des espèces végétales, aucun permis spécifique n'a été nécessaire, ni pour les sites, ni pour les activités (cultures autorisées au Canada). La dissémination dans l'environnement et l'utilisation comme aliment pour bétail du maïs cultivé (MON-00603-6 communément appelé NK603) a été autorisé par l'Agence canadienne d'inspection des aliments (Canadian Food Inspection Agency, document 2002-35). Nous confirmons que l'emplacement n'était pas une propriété privée ni protégée de quelque façon et que les études sur le terrain n'impliquaient pas d'espèces menacées ou protégées. Ce maïs OGM a été autorisé à l'importation et à la consommation dans l'Union européenne (réglementation CE 258/97).
2.2. Plantes, régimes et produits chimiques
Les variétés de maïs utilisées dans cette étude étaient le NK603 tolérant au R (compagnie
Monsanto, USA), et son plus proche contrôle isogénique non transgénique. Ces deux types de maïs ont été cultivés dans les mêmes conditions, sur le même site, avec une distance suffisante pour éviter la contamination croisée. La nature génétique, ainsi que la pureté des semences GM et la récolte, ont été confirmées par l'analyse qPCR d'échantillons d'ADN. Un champ de maïs NK603 a été traité avec du R à 3 ha/L (Weather-MAX, 540 g/L de glyphosate, Reg. EPA 524-537), et un autre champ de NK603 n'a pas été traité au R. Les céréales ont été récoltées lorsque le taux d'humidité était inférieur à 30% et ont séché à une température inférieure à 30°C. De ces trois cultures de maïs, des croquettes pour rats de laboratoire ont été fabriquées sur la base du régime alimentaire
standard A04 (Safe, France). Les croquettes ont été préparées pour contenir 11, 22 ou 33% de maïs transgénique, cultivé avec ou sans R, soit 33% de l'isogénique non transgénique. Les concentrations de transgène ont été confirmées dans les trois doses de chaque régime par qPCR. Toutes les formulations d'aliments ont consisté en une alimentation équilibrée, analysée chimiquement comme substantiellement équivalentes, sauf pour le transgène, et ne contenant pas de pesticides au-dessus des limites réglementaires. Tous les métabolites secondaires ne peuvent pas être connus ni mesurés dans la composition. Cependant, nous avons mesuré les isoflavones et les acides phénoliques, y compris l'acide férulique, par HPLC-UV. Tous les réactifs utilisés sont de qualité analytique. L'herbicide dilué dans l'eau de boisson était la formulation commerciale de R (GT Plus, 450 g/L de glyphosate, approbation 2020448, Monsanto, Belgique). Les niveaux d'herbicides ont été évalués par analyse du glyphosate dans les différentes dilutions en spectrométrie de masse. (Aflatoxines et autres mycotoxines étaient absentes ou en dessous des normes autorisées comme dans un environnement de Bonnes Pratiques de Laboratoire, note de la traduction).
2.3. Animaux et traitements
Les rats vierges albinos Sprague-Dawley âgés de 5 semaines ont été achetés chez Harlan
(Gannat, France). Tous les animaux étaient gardés dans des cages en polycarbonate (820 cm2, Genestil, France) avec deux animaux du même sexe par cage. La litière (Toplit classic, Safe, France) était remplacée deux fois par semaine. Les animaux étaient maintenus à 22 ± 3°C sous humidité (45-65%) et la pureté de l'air contrôlée avec un cycle de 12 h-jour/nuit, avec accès illimité à la nourriture et à l'eau. Chaque cage était régulièrement changée d'emplacement dans la salle d'expérience. Cette expérience vie entière de 2 ans a été menée dans un environnement BPL conformément aux lignes directrices de l'OCDE. Après 20 jours d'acclimatation, 100 mâles et 100 femelles ont été répartis de façon aléatoire sur la base du poids en 10 groupes équivalents. Pour chaque sexe, un groupe témoin avait accès à l'eau claire et l'alimentation standard issue du maïs contrôle (isogénique le plus proche non transgénique), six groupes ont été nourris avec 11, 22 et 33% de maïs GM NK603 traité ou non au R. Les trois derniers groupes ont été nourris avec l'alimentation contrôle et avaient accès à de l'eau additionnée respectivement de 1,1x 10-8 % de R (0,1 ppb soit 50 ng/L de glyphosate, le niveau de contamination de certaines eaux du robinet), 0,09% de R (400 mg/kg, LMR du glyphosate dans certains aliments GM aux USA) et 0,5% de R (2,25 g/L, la moitié de la dilution minimum pour usage agricole). L'alimentation et la boisson étaient changées chaque semaine. Le monitoring des animaux avait lieu deux fois par semaine, permettant l'observation attentive avec palpation des animaux, enregistrement des signes cliniques, mesure de toutes tumeurs palpables survenant, mesure de la consommation de nourriture et d'eau, et du poids du corps.
2.4. Analyses biochimiques
Des échantillons de sang ont été prélevés dans la veine de la queue de chaque rat sous
courte anesthésie à l'isoflurane avant le traitement et après 1, 2, 3, 6, 9, 12, 15, 18, 21 et 24 mois: 11 mesures ont été obtenues pour chaque animal vivant 2 ans. Il a d'abord été démontré que l'anesthésie n'avait pas d'impact sur la santé des animaux. Deux prélèvements de plasma et de sérum ont été préparés et stockés à – 80°C. Ensuite, 31 paramètres ont été mesurés (Tableau 1) selon les méthodes classiques, comprenant l'hématologie et les paramètres de coagulation, l'albumine, la globuline, la concentration totale en protéines, la créatinine, l'urée, le calcium, le sodium, le potassium, les chlorures, le phosphore inorganique, les triglycérides, le glucose, le cholestérol total,
l'alanine aminotransférase, l'aspartate aminotransférase, la gamma glutamyl-transférase (GT), l'estradiol, la testostérone. De plus, aux mois 12 et 24, la protéine C-réactive a été testée. Des échantillons d'urine ont été recueillis également 11 fois, au-delà de 24h dans des cages métaboliques individuelles, et 16 paramètres ont été mesurés comprenant la créatinine, le phosphore, le potassium, le sodium, le calcium, le pH et la clairance. A la fin de l'expérience, des échantillons de foie ont permis d'effectuer des mesures des activités des cytochromes CYP1A1, 1A2, 3A4 et 2C9 sur les fractions S9, ainsi que de la glutathione-S-transférase et la gamma-GT.
2.5. Anatomopathologie
Les animaux étaient euthanasiés au cours de l'étude seulement si la souffrance le rendait
nécessaire, en accord avec les règles d'éthique (par exemple 25% de perte de poids de corps, des tumeurs de plus de 25% du poids corporel, une hémorragie ou une prostration), et à la fin de l'étude par exsanguination sous anesthésie à l'isoflurane. Dans chaque cas, les organes suivants ont été recueillis : le cerveau, le colon, le cœur, les reins, le foie, les poumons, la rate, les ovaires, les testicules, les glandes surrénales, l'épididyme, la prostate, le thymus, l'utérus, l'aorte, la vessie, les os, le duodénum, l'œsophage, les yeux, l'iléon, le jéjunum, les ganglions lymphatiques, le système lympho-réticulaire, les glandes mammaires, le pancréas, les glandes parathyroïdes, les plaques de Peyer, l'hypophyse, les glandes salivaires, le nerf sciatique, la peau, la moelle épinière, l'estomac, la thyroïde et la trachée. Les 14 premiers organes (au moins 10 par animal en fonction du sexe, tableau 1) ont été pesés, ainsi que toutes les tumeurs apparues. Les neuf premiers organes ont été divisés en deux parties, une moitié a été immédiatement congelée dans de l'azote liquide ou de la glace carbonique. L'autre moitié et les autres organes ont été rincés dans du PBS et conservés dans du formaldéhyde à 4% pour l'anatomopathologie. Ces échantillons ont été inclus dans de la paraffine, montés sur lame et colorés avec la coloration histologique HES. Pour la microscopie électronique à transmission, les reins, le foie et les tumeurs ont été coupés en fragments de 1 mm3. Les échantillons ont été fixés et pré-réfrigérés dans du paraformaldéhyde 2%/ glutaraldéhyde à 2,5% dans du PBS 0,1 M pH 7,4 à 4°C pendant 3 h et traités comme décrit précédemment (Malatesta et al., 2002a).
2.6. Analyse statistique
Les données biochimiques ont été traitées par analyse multivariée avec le logiciel SIMCA-P
(V12) (UMETRICS AB Uméa, Suède). L'utilisation d'outils chimiométriques, par exemple l'analyse en composantes principales (ACP), par les moindres carrés partiels aux structures latentes (PLS), et PLS orthogonales (OPLS), sont des méthodes robustes pour la modélisation, l'analyse et l'interprétation des données biologiques et chimiques complexes. L'OPLS est une modification récente de la méthode PLS celle-ci étant une méthode de régression utilisée pour trouver la relation entre deux tableaux de données appelés X et Y. L'analyse de régression PLS (Eriksson et al., 2006b) consiste à calculer au moyen d'itérations successives, des combinaisons linéaires des variables X mesurées (variables explicatives). Ces combinaisons linéaires des variables X donnent les composantes PLS (vecteurs de score t). Une composante PLS peut être considérée comme une nouvelle variable - une variable latente - qui reflète les informations des variables X originales qui présente un intérêt pour la modélisation et la prédiction de la variable-réponse Y au moyen de la maximalisation des carrés de la covariance (Max COV2 (X, Y)). Le nombre de composantes est déterminé par validation croisée. Le logiciel SIMCA utilise l'algorithme itératif non linéaire Partial Least Squares algorithme (NIPALS) pour la régression PLS. L' « Orthogonal Partial Least Squares Discriminant Analysis (OPLS-DA) » a été
utilisée dans cette étude (Weljie et al, 2011;Wiklund et al, 2008). Le but de l'analyse discriminante est de trouver un modèle qui sépare les groupes d'observations sur la base de leurs variables X. La matrice X comprend les données biochimiques. La matrice Y contient des variables fictives qui décrivent l'appartenance de chaque observation à un groupe. Des variables binaires sont utilisées pour coder l'identité du groupe. L'analyse discriminante trouve un plan discriminant dans lequel les observations projetées sont bien séparées en fonction de chaque groupe. L'objectif de l'OPLS est de diviser la variation systématique dans le bloc-X en deux partie-modèles, une linéairement reliée à Y (dans le cas d'une analyse discriminante, l'appartenance à un groupe), et l'autre non apparentée à Y (orthogonale). Les composantes reliées à Y sont appelées prédictives, et celles non reliées à Y sont appelées orthogonales. Ce partitionnement des données X améliore la transparence du modèle et l'interprétation (Eriksson et al., 2006a).
3. Résultats
3.1. Mortalité
Au cours de l'expérience, les mâles témoins ont survécu en moyenne 624 ± 21 jours, tandis
que les femelles ont vécu pendant 701 ± 20 jours, auxquels il faut ajouter dans chaque cas 5 semaines (âge à la réception des animaux), plus les 3 semaines de la période de stabilisation. Après ce temps de survie écoulé, les décès survenus ont été considérés comme largement dus au vieillissement. Avant cette période, 30% des mâles témoins (trois au total) et 20% des femelles (seulement deux) sont décédés spontanément, tandis que 50% des mâles et 70% des femelles sont morts dans certains groupes dont le régime alimentaire contenait du maïs génétiquement modifié (Fig. 1). Cependant, le taux de mortalité n'était pas proportionnel à la dose de traitement, atteignant un seuil à la quantité de maïs GM la plus faible (11%) ou intermédiaire (22%) dans le régime équilibré, avec ou sans application de R sur la plante. Il est à noter que les deux premiers rats mâles qui sont morts dans les deux groupes traités par l'OGM ont dû être euthanasiés du fait de tumeurs rénales de Wilm qui dépassaient 25% du poids corporel. Et cela à peu près un an avant la mort du premier animal témoin. La première mort chez les femelles s'est produite dans le groupe contenant l'alimentation à 22% de maïs GM, causée par un fibroadénome mammaire 246 jours avant la première femelle témoin. La différence maximale de mortalité chez les mâles était de 5 fois plus de décès, au 17e mois dans le groupe consommant 11% de maïs GM, et chez les femelles, de 6 fois plus de mortalité au 21e mois avec le régime alimentaire contenant 22% de maïs GM avec et sans R. Chez les femelles, il y a eu 2-3 fois plus de décès dans tous les groupes traités par rapport aux témoins à la fin de l'expérience, et en général de façon plus précoce. Les femelles étaient plus sensibles à la présence de R dans l'eau de boisson que les mâles, comme en témoigne leur durée de vie plus courte. Les causes générales de la mort représentées en histogrammes (Fig. 1) sont liées principalement aux tumeurs des glandes mammaires chez les femelles, et à d'autres problèmes biologiques chez les mâles.
3.2. Observations anatomopathologiques
Tout au long de l'expérience, tous les rats ont été soigneusement surveillés pour leur
comportement leur apparence, les tumeurs palpables et les infections, et au moins 10 organes par animal ont été mesurés et jusqu'à 34 analysés post-mortem, à l'échelle macroscopique et/ou
microscopique (tableau 1). Toutes les données ne sont pas publiables dans un- seul- article, et seules les plus pertinentes sont décrites ici. Aucun rejet de l'alimentation avec ou sans OGM n'a été observé par les animaux, ni aucune différence majeure dans le poids corporel.
Les grosseurs palpables (au-dessus d'un diamètre de 17,5 mm chez les femelles et 20 mm
chez les mâles) se sont révélées être dans 95% des cas des tumeurs non régressives, et non des nodules infectieux. Au cours de l'expérimentation, ces grosseurs ont progressivement augmenté en taille et en nombre, mais pas proportionnellement à la dose dans le traitement (Fig. 2). Comme dans le cas des taux de mortalité, ceci suggère qu'un seuil a été atteint dès les plus faibles doses. Les tumeurs furent presque toujours plus fréquentes, rarement en nombre égal dans tous les groupes de traités, par rapport aux témoins, souvent 2-3 fois plus chez les deux sexes. Les tumeurs ont commencé à atteindre une grande taille, en moyenne 94 jours avant chez les femelles traitées et jusqu'à 600 jours plus tôt dans 2 groupes de mâles traités au maïs GM (11 et 22% avec ou sans R).
Chez les femelles, les grosses tumeurs étaient 5 fois plus fréquentes que chez les mâles après
2 ans, 93% d'entre elles étant des tumeurs mammaires. Adénomes, fibroadénomes et carcinomes sont délétères en raison de leur très grande taille, plus que le grade de la tumeur elle-même. La grande taille des tumeurs peut causer soit une gêne pour la respiration, la nutrition et/ou la digestion en fonction de leur localisation thoracique ou abdominale et peut également entraîner une hémorragie. De plus, un cystadénocarcinome métastatique de l'ovaire et deux tumeurs de la peau ont été identifiés. Des métastases ont été observées dans 2 cas seulement, l'un dans le groupe nourri avec 11% de maïs GM et un autre dans la dose la plus élevée de traitement au R.
Jusqu'à 14 mois, aucun animal des groupes témoins ne montrait de signe de tumeurs alors
que 10-30% des femelles traitées développaient des tumeurs, à l'exception d'un groupe (33% GMO + R). Au début du 24e mois, 50-80% des femelles avaient développé des tumeurs dans tous les groupes traités, avec un maximum de 3 tumeurs par animal, tandis que seulement 30% des témoins étaient touchés. Les groupes traités au R ont montré les plus forts taux de fréquence des tumeurs avec 80% des animaux atteints et jusqu'à 3 tumeurs pour une femelle, dans chaque groupe. Un résumé de toutes les tumeurs mammaires à la fin de l'expérience, indépendamment de la taille, est présenté dans le tableau 2. La même tendance a été observée dans les groupes recevant du R dans leur eau de boisson, toutes les femelles, sauf une (présentant un carcinome métastatique de l'ovaire), ont développé en plus des hypertrophies mammaires avec dans certains cas une hyperplasie avec atypie (tableau 2).
Le deuxième organe le plus touché chez les femelles était l'hypophyse, en général environ 2
fois plus que les témoins pour la plupart des traitements (tableau 2). A ce niveau encore, adénomes et/ou hyperplasies et hypertrophies ont été notées. Pour tous les groupes traités au R, 70-80% des animaux présentaient 1,4 à 2,4 fois plus d'anomalies que les témoins au niveau de cette glande.
A la fin de l'expérience, les grosses tumeurs palpables chez les mâles (dans les reins, et le
plus souvent la peau) étaient, en moyenne, deux fois plus fréquentes que chez les témoins, chez qui un fibrome de la peau est apparu au cours du 23e mois. A cela, des tumeurs internes non-palpables ont vu le jour, mais leurs quantités restaient toutefois plus faibles chez les mâles que chez les femelles. Ils n'étaient pas vraiment différents des témoins, bien que légèrement au-dessus chez les femelles (histogrammes Fig. 2).
Les organes les plus touchés chez les mâles étaient le foie, avec l'ensemble de l'appareil
hépatodigestif, et les reins (Tableau 2 et Fig. 3). Les congestions hépatiques, les foyers nécrotiques macroscopiques et microscopiques étaient de 2,5 à 5,5 fois plus fréquents dans tous les traitements par rapport aux groupes témoins. L'activité gamma GT hépatique a augmenté, en particulier pour les groupes OGM + R (jusqu'à 5,4 fois), ceci étant probablement dû à une maladie du foie.
De plus, les activités des cytochromes ont aussi généralement augmentées en présence de R
(dans l'eau de boisson ou dans l'alimentation GM), selon la dose et jusqu'à 5,7 fois à la dose la plus élevée. Les observations des échantillons de foie au microscope électronique à transmission ont confirmé les modifications pour tous les groupes traités, en ce qui concerne la dispersion du glycogène ou l'apparence en lacs, l'augmentation des corps résiduels et l'élargissement des cristaux dans les mitochondries (figure 4). Les groupes nourris au maïs GM avec ou sans application de R ont montré une transcription réduite des ARNm et des ARNr, en raison de la teneur élevée en hétérochromatine, et une diminution en composants nucléolaires fibrillaires denses. Dans le groupe OGM + R (à la dose la plus élevée), le réticulum endoplasmique lisse a considérablement augmenté et les nucléoles diminué de taille, devenant plus compacts. Pour le traitement au R seul, des tendances similaires ont été observées, avec une reprise partielle de l'activité nucléolaire à la dose la plus élevée.
La dégénérescence des reins avec des zones inflammatoires turgescentes démontre
l'augmentation de l'incidence des néphropathies progressives chroniques marquées et sévères, jusqu'à 2 fois plus élevée dans les groupes maïs GM 33% et à la dose la plus faible de R (tableau 2 et Fig. 3).
3.3. Analyses biochimiques
Pour les différents maïs et régimes alimentaires, l'étude de la composition chimique standard
n'a révélé aucune différence particulière ; c'est pourquoi ils ont été classés comme équivalents en substance, sauf pour la quantification en ADN du transgène. Par exemple, il n'y avait pas de différence entre les isoflavones totales. En outre, d'autres composés spécifiques qui ne sont pas toujours demandés pour l'établissement de l'équivalence en substance ont été analysés. Parmi les acides phénoliques, les seuls résultats consistants et significatifs (p <0,01) concernaient l'acide férulique diminué de 16-30% dans les régimes alimentaires contenant l'OGM et l'OGM + R, en comparaison au régime témoin (889 ± 107, 735 ± 89 respectivement vs contrôle 1057 ± 127 mg/kg) et l'acide caféique diminué de 21-53% (17,5 ± 2,1, 10,3 ± 1,3 vs contrôle 22,1 ± 2,6 mg/kg).
Pour les mesures biochimiques chez le rat, l'analyse statistique a été effectuée sur les
résultats obtenus à partir des échantillons prélevés au 15e mois, ce fut le dernier prélèvement où la plupart des animaux étaient encore en vie (90% des mâles traités, 94% des femelles traitées, et 100% des témoins). Les modèles à 2 classes en OPLS-DA ont été construits entre chaque groupe traité et les témoins, et par sexe. Seuls les modèles avec une variance explicative R2(Y) ≥ 80%, et une capacité prédictive par validation croisée Q2(Y) ≥ 60%, ont été utilisés pour la sélection des variables discriminantes (Fig. 5A) quand leurs coefficients de régression étaient significatifs au seuil de confiance de 99%. Ainsi, chez les femelles traitées, les déficiences rénales sont apparues au niveau biochimique (82% du total des paramètres perturbés). Les ions (Na, Cl) ou l'urée ont augmenté dans l'urine. Par conséquent, les mêmes ions étaient diminués dans le sérum (figure 5B), tout comme les niveaux de P, K et Ca. La créatinine ou la clairance ont diminué dans les urines pour tous les
traitements par rapport aux témoins femelles (tableau 3). Pour les mâles traités au maïs GM (avec ou sans R), 87% de variables discriminantes étaient reliées aux reins, mais les profils perturbés étaient moins évidents en raison des néphropathies chroniques avancées et des décès. En résumé, pour tous les traitements et dans les deux sexes, 76% des variables discriminantes étaient liées aux reins par rapport aux témoins.
En outre, chez les femelles (tableau 3) la balance androgène / strogène dans le sérum a été
modifiée par les traitements au maïs GM et les traitements au R (au moins au seuil de confiance de 95%, Fig. 5B), et pour les mâles; à la plus forte dose de traitement au R, les niveaux d'estrogènes ont plus que doublé.
4. Discussion
Ce rapport décrit la première étude de toxicologie vie entière sur rongeurs (rats) recherchant
de possibles effets toxiques d'un maïs génétiquement modifié tolérant le R (NK603) et d'une formulation commerciale complète de l'herbicide R.
Nos données ont montré, comme c'est souvent le cas pour les maladies hormonales, que les
effets les plus observés dans cette étude n'étaient pas proportionnels à la dose de traitement (maïs transgénique avec et sans application de R; R seul), non-monotone et avec un effet de seuil (Vandenberg et al., 2012). On a remarqué également que des degrés similaires de symptômes pathologiques apparaissaient à partir des plus basses et jusqu'aux plus hautes doses, suggérant un effet de seuil. Cela correspondrait à des niveaux susceptibles de découler de la consommation ou l'exposition environnementale, tels que 11% de maïs GM dans la nourriture, ou 50 ng/L de glyphosate en formulation de R, comme cela peut se trouver dans certaines eaux du robinet contaminées ; et ces valeurs entrent dans les limites autorisées.
La durée de vie du groupe des témoins correspondait à la durée de vie moyenne des rats,
mais comme c'est fréquemment le cas chez la plupart des mammifères y compris les humains (OMS, 2012), les mâles sont morts en moyenne avant les femelles, à l'exception de quelques groupes de femelles traitées. Tous les traitements dans les deux sexes ont accru l'incidence des grosses tumeurs de 2 à 3 fois en comparaison des témoins, mais aussi le nombre de tumeurs mammaires par rapport à la même souche Sprague Dawley Harlan (Brix et al., 2005), et dans l'ensemble autour de 3 fois plus par rapport à la plus grande analyse de1329 rats Sprague-Dawley femelles (Chandra et al., 1992). Dans notre étude, les tumeurs se développaient considérablement plus vite que chez les témoins, même si la majorité des tumeurs furent observées après 18 mois. Les premières grandes tumeurs détectables sont arrivées respectivement à 4 et 7 mois chez les mâles et les femelles, ce qui souligne l'insuffisance des tests standards à 90 jours pour l'évaluation de la toxicité de l'alimentation et des cultures GM (Séralini et al., 2011).
La souffrance induisant l'euthanasie et la mort concernait principalement les femelles
développant de grosses tumeurs mammaires. Celles-ci semblaient être clairement liées aux différents traitements lors de la comparaison au groupe témoin. Ces tumeurs sont généralement connues comme étant dépendantes des estrogènes (Harvell et al., 2000). Nous avons observé une induction marquée frappante des tumeurs mammaires par le R seul, un pesticide majeur en
formulation, même à la plus faible dose administrée. Il a été montré que le R perturbe l'aromatase, enzyme qui synthétise les estrogènes (Richard et al., 2005), mais aussi que le R interfère avec les récepteurs des estrogènes et des androgènes dans les cellules (Gasnier et al., 2009). En outre, le R apparaît être un perturbateur endocrinien
in vivo également chez les mâles (Romano et al., 2010). Les stéroïdes sexuels sont également modifiés chez les rats traités. Ces phénomènes hormono-dépendants sont confirmés par un dysfonctionnement accru de l'hypophyse chez les femelles traitées. Un mécanisme de rétroaction modifié par les estrogènes pourrait agir à ce niveau (Popovics et al., 2011; Walf et Frye, 2010). Les profils pathologiques similaires provoqués par le maïs GM contenant des résidus de R pourraient par conséquent être expliqués par les résidus de R eux-mêmes, sachant que la dose moyenne de traitement au R correspond à des niveaux acceptables de ces résidus de pesticides dans les OGM. Fait intéressant, dans les groupes d'animaux nourris avec le maïs NK603 sans application de R, des effets similaires à l'égard de l'incidence accrue des tumeurs et du taux de mortalité ont été observés. Une explication plausible à cette situation serait la production d'un ou de plusieurs composé(s) spécifique(s), qui se retrouverait dans l'alimentation GM, et qui pourrait être directement toxique et/ou provoquer l'inhibition de voies métaboliques qui, à leur tour, pourraient générer des effets toxiques chroniques. Et ceci malgré le fait que la variété de maïs génétiquement modifié utilisé dans cette étude a été jugée par l'industrie et les organismes de réglementation comme étant équivalente en substance par rapport à la variété isogénique la plus proche non-GM. Comme la composition chimique totale du maïs génétiquement modifié ne peut pas être mesurée en détail, l'utilisation de l'équivalence en substance est insuffisante pour mettre en évidence de potentielles toxines inconnues et ne peut donc pas remplacer des études de toxicologie des OGM à long terme sur animaux. Une explication de ces effets pourrait être que le maïs NK603 génétiquement modifié utilisé dans cette étude a été conçu pour surexprimer une version modifiée de la 5-énolpyruvylshikimate-3-phosphate synthase (EPSPS) provenant
d'Agrobacterium tumefaciens (Hammond et al., 2004) permettant la tolérance au R. L'EPSPS modifiée n'est pas inhibée par le glyphosate contrairement à l'enzyme sauvage. Dans la plante, l'EPSPS est connue pour catalyser la première étape de la biosynthèse des acides aminés aromatiques par la voie du shikimate ; en outre les isoflavones estrogéniques et leurs glycosides sont également des produits de cette voie de biosynthèse (Duke et al., 2003). Ils n'ont pas été perturbés dans notre étude. En revanche, les niveaux des acides caféique et férulique dans les régimes alimentaires génétiquement modifiés, qui sont aussi des métabolites secondaires issus de cette voie, mais qui ne sont pas toujours mesurés dans les tests réglementaires, sont considérablement réduits. Cela pourrait diminuer leurs effets protecteurs contre la carcinogenèse et même contre les tumeurs mammaires (Kuenzig et al., 1984; Baskaran et al., 2010). En outre, ces acides phénoliques et en particulier l'acide férulique pourraient moduler les récepteurs des estrogènes ou la voie estrogénique dans les cellules de mammifères (Chang et al., 2006). Cela n'exclut pas l'action d'autres métabolites inconnus. Cette explication correspond également au fait que les effets observés du NK603 et de R ne sont pas cumulatifs et atteignent un seuil. Ce qui implique que le maïs NK603 et le R pourraient provoquer des troubles hormonaux dans la même voie biochimique et physiologique.
Comme prévu, les tumeurs mammaires chez les mâles étaient beaucoup moins fréquentes
que chez les femelles. La mort chez les rats mâles était principalement due au développement de graves insuffisances hépatorénales, confirmant les premiers signes de toxicité observés dans les tests à 90 jours avec le maïs NK603 (Spiroux de Vendômois et al., 2009). Chez les femelles, les fuites d'ions au niveau des reins ont été mises en évidence au niveau biochimique au 15ème mois, tandis des
néphropathies graves ont été retrouvées au niveau anatomo-pathologique chez les mâles morts par la suite. Des signes de toxicité précoce dans les reins et le foie ont également été observés à 3 mois pour 19 plantes GM comestibles contenant des résidus de pesticides (Séralini et al., 2011). En fait, seuls les rats mâles âgés sont sensibles aux néphropathies progressives chroniques (Hard et Khan, 2004). La perturbation des paramètres rénaux peut avoir été induite par la diminution des acides phénoliques dans notre étude, puisque les acides caféique et férulique sont bénéfiques pour le rein en empêchant le stress oxydatif (Srinivasan et al, 2005; U Rehman et Sultana, 2011). Néanmoins, nous avions précédemment démontré que des extraits végétaux contenant ces mêmes acides féruliques et caféiques favorisaient la désintoxication des cellules embryonnaires de rein après contamination au R (Gasnier et al., 2011). Il est ainsi possible que la consommation de NK603, en réduisant ces composés, puisse ainsi provoquer un vieillissement prématuré de la physiologie rénale, comme pour le R, par le stress oxydatif.
Les perturbations qui se sont produites dans le foie des mâles sont caractéristiques d'une
intoxication chronique, confirmée par des altérations dans les paramètres biochimiques du fonctionnement du foie et des reins. L'observation du fait que le fonctionnement hépatique chez les femelles est moins affecté peut être due à leur physiologie mieux adaptée au métabolisme des estrogènes. En outre, il a clairement été démontré que les enzymes hépatiques sont spécifiques au sexe dans leurs profils d'expression, y compris dans une étude à 90 jours chez des rats nourris avec du maïs NK603 (Spiroux de Vendômois et al., 2009). Cependant, dans une étude à long terme, la preuve du vieillissement précoce du foie avait été observée chez des souris femelles nourries avec du soja GM tolérant au R (Malatesta et al., 2008a). Dans la présente étude, une analyse plus approfondie au niveau ultrastructural a révélé l'existence d'un blocage de la transcription ainsi que d'autres anomalies dans la structure nucléaire des hépatocytes qui étaient comparables pour les deux sexes, et proportionnels à la dose dans tous les traitements. Ceci est cohérent avec les effets toxiques bien documentés de très faibles dilutions de R sur l'apoptose, la fonction mitochondriale, et la destruction de la membrane cellulaire induisant la nécrose des hépatocytes, et d'autres lignées cellulaires (Benachour et Séralini, 2009; Benachour et al., 2007; Gasnier et al, 2010;. Peixoto, 2005).
Les perturbations au moins des voies liées aux estrogènes et/ou l'augmentation du stress
oxydatif par tous les traitements nécessitent de pousser plus loin les investigations. Cela peut se faire par l'application de méthodes de transcriptomique, de protéomique et de métabolomique pour analyser les profils moléculaires des reins et des foies, ainsi que celui du maïs GM NK603 (Jiao et al, 2010; Zhou et al, 2009; Zolla et al, 2008). Les autres causes possibles des effets pathogènes qui ont été observés pourraient être une modification de l'expression des gènes due aux effets de l'insertion de transgène, ou à des effets mutagènes ou métaboliques (Latham et al., 2006;. Wilson et al, 2006) comme cela a été montré pour le maïs GM MON810 (Rosati et al., 2008). Une perturbation conséquente du métabolisme général dans l'OGM ne peut être exclue, ce qui pourrait conduire, par exemple, à la production d'autres composés potentiellement actifs tels que des micro-ARN (Zhang et al., 2012) ou les leucotoxines diols (Markaverich et al., 2005).
En conclusion, il était déjà connu que la consommation de glyphosate dans l'eau au-dessus
des limites autorisées pouvait provoquer des dysfonctionnements rénaux et hépatiques (EPA). Les résultats de l'étude présentée ici démontrent clairement que des niveaux inférieurs de formulations complètes d'herbicides à base de glyphosate, à des concentrations bien en dessous des limites officielles de sécurité, induisent des problèmes hépatiques, rénaux et mammaires hormono-
dépendants. De même, la perturbation des voies de biosynthèse qui peuvent résulter de la surexpression du transgène EPSPS dans le maïs génétiquement modifié NK603 peut donner lieu à des pathologies comparables qui pourraient être liées à des métabolites anormaux ou en proportions déséquilibrées d'acides phénoliques, ou liés à des composés apparentés . D'autres effets mutagènes et métaboliques de cet OGM alimentaire ne peuvent être exclus. Ce sera l'objet d'études futures, y compris l'analyse de la présence de transgène et de glyphosate dans les tissus de rats. Des études de reproduction et des études multi-générationnelles serviront également à fournir des informations nouvelles sur ces problèmes. Cette étude est la première étude détaillée sur les effets délétères à long terme liés à la consommation d'un maïs GM tolérant au R et de R, l'herbicide le plus utilisé dans le monde.
En fait, les perturbations biochimiques significatives et les problèmes physiologiques
importants documentés dans ce travail confirment les effets pathologiques de ces traitements OGM et R pour les deux sexes, avec des amplitudes différentes. Nous proposons que les OGM agricoles alimentaires et les pesticides en formulation soient évalués avec soin par des études à long terme permettant de mesurer leurs effets toxiques potentiels.
Conflits d'intérêts
Les auteurs déclarent qu'ils n'ont pas de conflits d'intérêts.
Nous remercions Michael Antoniou pour son aide en anglais et ses commentaires constructifs sur le manuscrit, ainsi que Herrade Hemmerdinger pour la relecture. Nous tenons à remercier l'Association CERES, la Fondation « Charles Léopold Mayer pour le Progrès de l'Homme », le Ministère français de la Recherche, et le CRIIGEN pour leur soutien majeur.
Protocole suivi et comparaison avec l'évaluation existante, et avec les tests réglementaires non obligatoires.
Traitements et analyses
Notre travail
Hammond et al., 2004
Tests réglementaires
Traitements
OGM NK603 + Roundup,
+ contrôles
OGM NK603 + Roundup, maïs isogénique le plus
Roundup, et maïs
(dans l'alimentation ou
isogénique le plus proche
et 6 autres variétés de maïs
l'eau de boisson)
non équivalentes en substance
Doses par traitement
3 (subchronique: 13
Durée en mois
Animaux mesurés
Au moins 10 rongeurs
/ groupe / sexe
(200 rats mesurés)
(200 rats mesurés/400)
par cage (même sexe)
Monitoring / semaine
Consommation de nourriture
Nourriture uniquement
Nourriture au minimum
et eau de boisson Organes et tissus étudiés
Plus forte dose et contrôles
histologie / animal
organes pesés
Microscopie électronique
Etudes du comportement
1 (protocole non indiqué)
(nombre)
Ophtalmologie (nombre)
Nombre d'échantillons de
11, chaque mois (0-3)
Puis tous les 3 mois
2, semaines 4 et 13
sang/ animal
Paramètres sanguins
31 (11 fois en général)
25 minimums (2 fois min.)
Stéroïdes sexuels
Non, sauf si perturbation
Testostérone, estradiol
endocrine suspectée
Paramètres du
tissuhépatique
Nombre d'échantillons
Facultatif, dernière
paramètres étudiés
Microbiologie (fécès ou
urine) Résidus de Roundup dans les
tissus
Transgene dans les tissus
Le protocole suivi pour ce travail a été comparé à l'évaluation réglementaire du maïs NK603 réalisée par
la compagnie (Hammond et al., 2004), et avec les tests in vivo réglementaires non-obligatoires pour les
OGM, ou obligatoires pour les produits chimiques (OCDE 408, 1998). Seuls les résultats les plus importants
sont montrés dans cette publication.
Organes et pathologies
Tractus hépatodigestif
Femelles, tumeurs mammaires
Glandes mammaires
Table 2
Résumé des pathologies observées les plus fréquentes.
Après le nombre d'anomalies pathologiques, le nombre de rats atteints est indiqué entre parenthèses. Chez les
mâles, les congestions du foie, les tâches macroscopiques et les foyers microscopiques sont importants. Les
problèmes hépatodigestifs concernent le foie, l'estomac et l'intestin grêle (duodenum, ileum or jejunum).
Seules les néphropathies progressives chroniques (CPN) marquées et sévères sont recensées, excluant les deux
néphroblastomes dans les groupes OGM 11% et OGM 22%+R. Chez les femelles, les fibroadénomes et les
adénocarcinomes mammaires sont les principales tumeurs; des galactocèles et des hyperplasies avec atypie
ont aussi été observées. Les dysfonctionnements de l'hypophyse incluent des adénomes, des hyperplasies et
des hypertrophies. Pour les détails des traitements, se reporter aux légendes de la Fig.1.
Table 3. Pourcentage de variation des paramètres indiquant des problèmes rénaux chez les
femelles.
Variables discriminantes
Diminution dans
dans l'urine
Diminution dans le
L'analyse OPLS-DA a été conduite sur 48 variables au 15ème mois. Ici nous montrons les différences des moyennes (%) des variables (discriminantes au niveau de confiance de 99%, en gras) indiquant les paramètres rénaux des animaux femelles, ainsi que les hormones sexuelles. Les pathologies rénales des mâles sont déjà illustrées dans la Table 2.
Figure 1. Mortalité des rats nourris à l'OGM traité ou non au Roundup, et effets du Roundup seul. Les rats ont été nourris avec le maïs GM NK603 (avec ou sans application de Roundup) à 3 doses
différentes (11, 22, 33% dans la nourriture: en traits fin, moyen et gras, respectivement) comparées
au maïs non-GM isogénique le plus proche équivalent en substance (témoin, en pointillé). Le
Roundup a été administré dans l'eau de boisson à 3 doses croissantes, mêmes symboles utilisés
[teneur environnementale (A), LMR dans les OGM agricoles (B) et moitié du niveau minimal utilisé en
agriculture (C), (cf. matériels et méthodes). L'espérance de vie pendant l'expérience du groupe
témoin est représentée par les barres verticales +/- SEM (zones grisées). Dans les histogrammes, les
causes de la mort avant la zone grise sont détaillées en comparaison avec les témoins (0). Les
euthanasies nécessaires du fait de la souffrance en accord avec les règles éthiques (tumeur
supérieure à 25% du poids du corps, perte de poids supérieure à 25%, saignement hémorragique,
etc.) sont représentées en noir; les morts spontanées sont représentées en hachuré.
Fig 2. Grosses tumeurs non-régressives chez les rats nourris à l'OGM traité ou non au Roundup, et
effets du Roundup seul. Les symboles des courbes et les traitements sont expliqués dans la légende
de la Fig. 1. Les grosses tumeurs palpables pendant l'expérience sont comptabilisées à partir d'un
diamètre de 20 x 20 mm pour les mâles et 17,5 x 17,5 mm pour les femelles. Au-dessus de cette
taille, 95% des tumeurs sont non-régressives. Toutes les tumeurs sont indiquées dans les
histogrammes : grosses tumeurs non régressives en noir, petites tumeurs internes en blanc, et
métastases en gris.
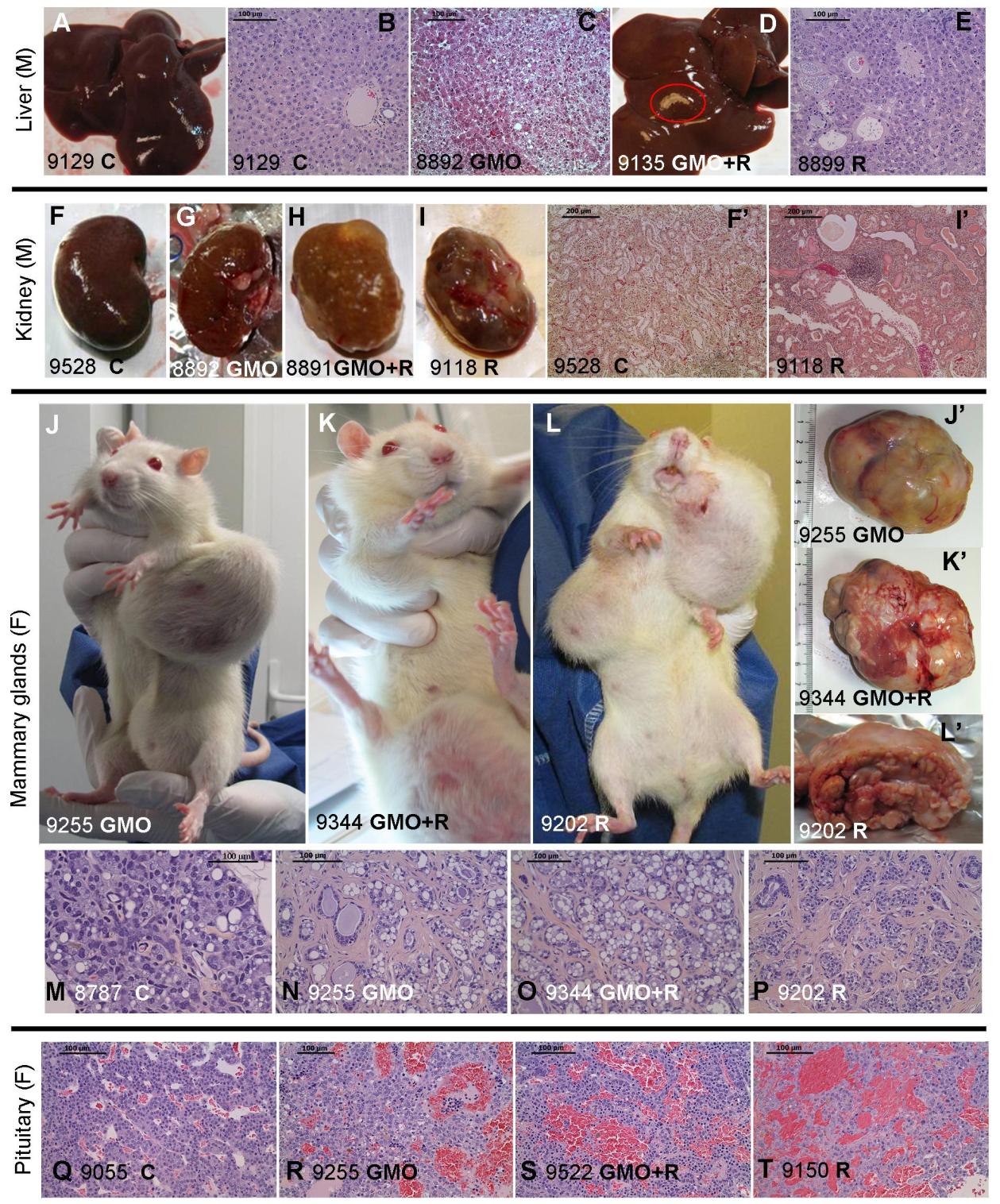
Figure 3. Observations en anatomopathologie des rats nourris à l'OGM traité ou non au Roundup,
et effets du Roundup seul. Les photographies macroscopiques et microscopiques montrent les foies
des mâles (A-E) et leurs reins gauches (F-I'), les glandes mammaires (J-P) et les hypophyses (Q-T) chez
les femelles, en illustration de la Table 2. Le numéro de chaque animal ainsi que son traitement sont
spécifiés. Les tâches pâles macroscopiques (D),les foyers nécrotiques microscopiques dans le foie (C
focus à cellules claires, E focus basophiles avec atypie), et les néphropathies progressives chroniques
marquées et sévères sont illustrés. Chez les femelles, les tumeurs mammaires (J,J',N adénocarcinome
et K,K',L,L',O,P fibroadénomes) et les adénomes de l'hypophyse (R-T) sont montrés et comparés aux
témoins (C suivi du numéro du rat).
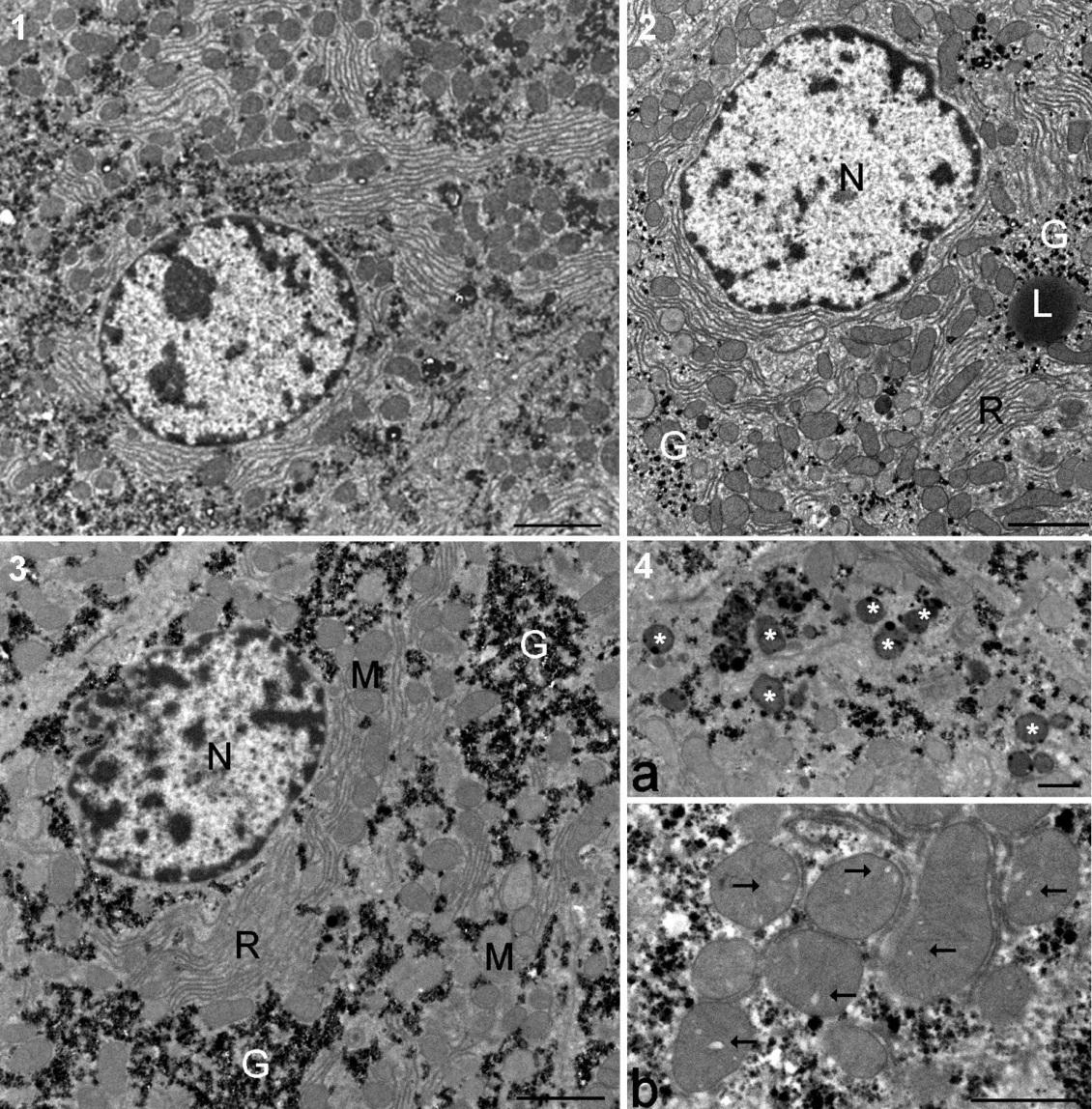
Figure 4. Ultrastructure des hépatocytes chez les rats mâles à partir des groupes présentant le plus
haut degré de pathologie du foie. 1. Hépatocyte typique de rat témoin (barre 2 µm sauf dans le 4). 2.
Effets du Roundup à faible dose. Le Glycogène (G) est dispersé dans le cytoplasme. L, gouttelette
lipidique; N, noyau; R réticulum endoplasmique rugueux. 3. Hépatocytes d'animal nourri au maïs GM
(GMO) à 22% de la nourriture totale. On observe de grands lacs de glycogène dans le cytoplasme. M,
mitochondrie. 4. Détails des effets du traitement à 22% d'OGM (barre 1 µm). a. Groupe de corps
résiduels (astérisques). b. Les mitochondries montrent de nombreux cristaux élargis (flèches).
Figure 5. Analyse discriminante par mesure des moindres carrés partiaux orthogonaux (OPLS-DA)
pour les données biochimiques (femelles nourries à 33% d'OGM versus témoins). (A) Les
coefficients de régression pour la composante prédictive, avec intervalles de confiance « jack-
knifed » à 99% de seuil de confiance, en OPLS-DA, indiquent les paramètres discriminants par rapport
aux témoins au 15ème mois (Abréviations: U urinaire, UEx excrété dans l'urine en 24h, APPT temps de
thromboplastine partielle activée, MCV volume corpusculaire moyen, PT temps de prothrombine,
RBC globules rouges, ALT Alanine aminoTransférase, MCHC concentration en hémoglobine
corpusculaire moyenne, A/G ratio albumine/globuline, WBC globules blancs, AST ASpartate
aminoTransférase). (B) Dans ce cas, des exemples détaillés de distribution de variables
significativement discriminantes entre les femelles nourries à 33% d'OGM (en gras) et les témoins
(en pointillé). Sur l'axe des abscisses : les animaux; sur l'axe des ordonnées : valeurs dans le sérum ou
l'urine des ions sodium (Na) et chlorure (Cl), de l'estradiol et de la testostérone. Les profils mettent
en évidence les fuites ioniques au niveau des reins et la perturbation de l'équilibre des hormones
sexuelles par rapport aux témoins.
Références bibliographiques :
Baskaran, N., Manoharan, S., Balakrishnan, S., Pugalendhi, P., 2010. Chemopreventive potential of ferulic acid in 7,12-dimethylbenz[a]anthracene-induced mammary carcinogenesis in Sprague-Dawley rats. Eur J Pharmacol. 637, 22-9. Benachour, N., Seralini, G.E., 2009. Glyphosate formulations induce apoptosis and necrosis in human umbilical, embryonic, and placental cells. Chem Res Toxicol 22, 97-105. Benachour, N., Sipahutar, H., Moslemi, S., Gasnier, C., Travert, C., Seralini, G.E., 2007. Time- and dose-dependent effects of roundup on human embryonic and placental cells. Arch Environ Contam Toxicol 53, 126-133. Brix, A.E., Nyska, A., Haseman, J.K., Sells, D.M., Jokinen, M.P., Walker, N.J., 2005. Incidences of selected lesions in control female Harlan Sprague-Dawley rats from two-year studies performed by the National Toxicology Program. Toxicol Pathol 33, 477-483. Chandra, M., Riley, M.G., Johnson, D.E., 1992. Spontaneous neoplasms in aged Sprague-Dawley rats. Arch Toxicol 66, 496-502. Chang, C.J., Chiu, J.H., Tseng, L.M., Chang, C.H., Chien, T.M., Wu, C.W., Lui, W.Y., 2006. Modulation of HER2 expression by ferulic acid on human breast cancer MCF7 cells. Eur J Clin Invest 36, 588-596. Cox, C., 2004. Herbicide factsheet - Glyphosate. J. pesticide reform 24, 10-15. Cox, C., Surgan, M., 2006. Unidentified inert ingredients in pesticides: implications for human and environmental health. Environ Health Perspect 114, 1803-1806. Domingo, J.L., Giné Bordonaba, J., 2011. A literature review on the safety assessment of genetically modified plants. Environ Int 37, 734-742. Duke, S.O., Rimando, A.M., Pace, P.F., Reddy, K.N., Smeda, R.J., 2003. Isoflavone, glyphosate, and aminomethylphosphonic acid levels in seeds of glyphosate-treated, glyphosate-resistant soybean. J Agric Food Chem 51, 340-344. EPA, Basic Information about Glyphosate in Drinking Water. http://water.epa.gov/drink/contaminants/basicinformation/glyphosate.cfm (Last access June 25, 2012) Eriksson, L., Johansson, E., Kettaneh-Wold, N., J.Trygg, Wikström, C., Wold, S., 2006a. Multi- and Megavariate Data Analysis Part II. Advanced Applications and Method Extensions. Umetrics, Umea, Sweden. Eriksson, L., Johansson, E., kettaneh-Wold, N., Wold, S., 2006b. Multi and Megavariate Data Analysis Part I - Principles and Applications. Umetrics AB, Umea, Sweden. Gasnier, C., Benachour, N., Clair, E., Travert, C., Langlois, F., Laurant, C., Decroix-Laporte, C., Séralini, G.-E., 2010. Dig1 protects against cell death provoked by glyphosate-based herbicides in human liver cell lines. J Occup Med Toxicol 5, 29. Gasnier, C., Dumont, C., Benachour, N., Clair, E., Chagnon, M.C., Seralini, G.E., 2009. Glyphosate-based herbicides are toxic and endocrine disruptors in human cell lines. Toxicology 262, 184-191. Gasnier, C., Laurant, C., Decroix-Laporte, C., Mesnage, R., Clair, E., Travert, C., Séralini, G.E., 2011. Defined plant extracts can protect human cells against combined xenobiotic effects. J Occup Med Toxicol. 6, 3. Hammond, B., Dudek, R., Lemen, J., Nemeth, M., 2004. Results of a 13 week safety assurance study with rats fed grain from glyphosate tolerant corn. Food Chem Toxicol 42, 1003-1014. Hammond, B., Lemen, J., Dudek, R., Ward, D., Jiang, C., Nemeth, M., Burns, J., 2006a. Results of a 90-day safety assurance study with rats fed grain from corn rootworm-protected corn. Food Chem Toxicol 44, 147-160. Hammond, B.G., Dudek, R., Lemen, J.K., Nemeth, M.A., 2006b. Results of a 90-day safety assurance study with rats fed grain from corn borer-protected corn. Food Chem Toxicol 44, 1092-1099. Hard, G.C., Khan, K.N., 2004. A contemporary overview of chronic progressive nephropathy in the laboratory rat, and its significance for human risk assessment. Toxicol Pathol 32, 171-180. Harvell, D.M., Strecker, T.E., Tochacek, M., Xie, B., Pennington, K.L., McComb, R.D., Roy, S.K., Shull, J.D., 2000. Rat strain-specific actions of 17beta-estradiol in the mammary gland: correlation between estrogen-induced lobuloalveolar hyperplasia and susceptibility to estrogen-induced mammary cancers. Proc Natl Acad Sci U S A 97, 2779-2784. Jiao, Z., Si, X.X., Li, G.K., Zhang, Z.M., Xu, X.P., 2010. Unintended compositional changes in transgenic rice seeds (Oryza sativa L.) studied by spectral and chromatographic analysis coupled with chemometrics methods. J Agric Food Chem 58, 1746-1754. Krogh, K.A., Vejrup, K.V., Mogensen, B.B., Halling-Sørensen, B., 2002. Liquid chromatography-mass spectrometry method to determine alcohol ethoxylates and alkylamine ethoxylates in soil interstitial water, ground water and surface water samples. Journal of Chromatography A 957, 45-57. Kuenzig, W., Chau, J., Norkus, E., Holowaschenko, H., Newmark, H., Mergens, W., Conney, A.H., 1984. Caffeic and ferulic acid as blockers of nitrosamine formation. Carcinogenesis. 5, 309-13. Latham, J.R., Wilson, A.K., Steinbrecher, R.A., 2006. The mutational consequences of plant transformation. J Biomed Biotechnol 2006, 25376. Malatesta, M., Boraldi, F., Annovi, G., Baldelli, B., Battistelli, S., Biggiogera, M., Quaglino, D., 2008a. A long-term study on female mice fed on a genetically modified soybean: effects on liver ageing. Histochem Cell Biol 130, 967-977. Malatesta, M., Caporaloni, C., Gavaudan, S., Rocchi, M.B., Serafini, S., Tiberi, C., Gazzanelli, G., 2002a. Ultrastructural morphometrical and immunocytochemical analyses of hepatocyte nuclei from mice fed on genetically modified soybean. Cell Struct Funct 27, 173-180. Malatesta, M., Caporaloni, C., Rossi, L., Battistelli, S., Rocchi, M.B., Tonucci, F., Gazzanelli, G., 2002b. Ultrastructural analysis of pancreatic acinar cells from mice fed on genetically modified soybean. J Anat 201, 409-415. Malatesta, M., Perdoni, F., Santin, G., Battistelli, S., Muller, S., Biggiogera, M., 2008b. Hepatoma tissue culture (HTC) cells as a model for investigating the effects of low concentrations of herbicide on cell structure and function. Toxicol In Vitro 22, 1853-1860. Markaverich, B.M., Crowley, J.R., Alejandro, M.A., Shoulars, K., Casajuna, N., Mani, S., Reyna, A., Sharp, J., 2005. Leukotoxin diol s from ground corncob bedding disrupt estrous cyclicity in rats and stimulate MCF-7 breast cancer cell proliferation. Environ Health Perspect 113, 1698-1704. Mesnage, R., Clair, E., Séralini, G.-E., 2010. Roundup in Genetically modified crops: Regulation and toxicity in mammals. Theorie in der Ökologie 16, 31-33. Monosson, E., 2005. Chemical mixtures: considering the evolution of toxicology and chemical assessment. Environ Health Perspect 113, 383-390. Peixoto, F., 2005. Comparative effects of the Roundup and glyphosate on mitochondrial oxidative phosphorylation. Chemosphere 61, 1115-1122. Popovics, P., Rekasi, Z., Stewart, A.J., Kovacs, M., 2011. Regulation of pituitary inhibin/activin subunits and follistatin gene expression by GnRH in female rats. J Endocrinol 210, 71-79. Richard, S., Moslemi, S., Sipahutar, H., Benachour, N., Seralini, G.E., 2005. Differential effects of glyphosate and roundup on human placental cells and aromatase. Environ Health Perspect 113, 716-720. Romano, M.A., Romano, R.M., Santos, L.D., Wisniewski, P., Campos, D.A., de Souza, P.B., Viau, P., Bernardi, M.M., Nunes, M.T., de Oliveira, C.A., 2012. Glyphosate impairs male offspring reproductive development by disrupting gonadotropin expression. Arch Toxicol. 86, 663-73. Romano, R.M., Romano, M.A., Bernardi, M.M., Furtado, P.V., Oliveira, C.A., 2010. Prepubertal exposure to commercial formulation of the herbicide glyphosate alters testosterone levels and testicular morphology. Arch Toxicol 84, 309-317. Rosati, A., Bogani, P., Santarlasci, A., Buiatti, M., 2008. Characterisation of 3' transgene insertion site and derived mRNAs in MON810 YieldGard maize. Plant Mol Biol 67, 271-281. Séralini, G.-E., Cellier, D., de Vendomois, J.S., 2007. New analysis of a rat feeding study with a genetically modified maize reveals signs of hepatorenal toxicity. Archives of Environmental Contamination and Toxicology 52, 596-602. Séralini, G.-E., Mesnage, R., Clair, E., Gress, S., Spiroux De Vendomois, J., Cellier, D., 2011. Genetically modified crops safety assessments: present limits and possible improvements. Environmental Sciences Europe 23. Séralini, G.E., Spiroux de Vendomois, J., Cellier, D., Sultan, C., Buiatti, M., Gallagher, L., Antoniou, M., Dronamraju, K.R., 2009. How subchronic and chronic health effects can be neglected for GMOs, pesticides or chemicals. Int J Biol Sci 5, 438-443. Snell, C., Bernheim, A., Bergé, J.-B., Kuntz, M., Pascal, G., Paris, A., Ricroch, A.E., 2011. Assessment of the health impact of GM plant diets in long-term and multigenerational animal feeding trials: A literature review. Food Chem Toxicol. 50, 1134-1148.
Spiroux de Vendômois, J., Cellier, D., Velot, C., Clair, E., Mesnage, R., Seralini, G.E., 2010. Debate on GMOs health risks after statistical findings in regulatory tests. Int J Biol Sci 6, 590-598. Spiroux de Vendômois, J., Roullier, F., Cellier, D., Seralini, G.E., 2009. A comparison of the effects of three GM corn varieties on mammalian health. Int J Biol Sci 5, 706-726. Srinivasan, M., Rukkumani, R., Ram Sudheer, A., Menon, V.P., 2005. Ferulic acid, a natural protector against carbon tetrachloride-induced toxicity. Fundam Clin Pharmacol. 19, 491-6. U Rehman, M., Sultana, S., 2011 Attenuation of oxidative stress, inflammation and early markers of tumor promotion by caffeic acid in Fe-NTA exposed kidneys of Wistar rats. Mol Cell Biochem. 357, 115-24. Vandenberg, L.N., Colborn, T., Hayes, T.B., Heindel, J.J., Jacobs, D.R., Jr., Lee, D.H., Shioda, T., Soto, A.M., Vom Saal, F.S., Welshons, W.V., Zoeller, R.T., Myers, J.P., 2012. Hormones and Endocrine-Disrupting Chemicals: Low-Dose Effects and Nonmonotonic Dose Responses. Endocr Rev. 33, 378-455 Walf, A.A., Frye, C.A., 2010. Raloxifene and/or estradiol decrease anxiety-like and depressive-like behavior, whereas only estradiol increases carcinogen-induced tumorigenesis and uterine proliferation among ovariectomized rats. Behav Pharmacol 21, 231-240. Weljie, A.M., Bondareva, A., Zang, P., Jirik, F.R., 2011. (1)H NMR metabolomics identification of markers of hypoxia-induced metabolic shifts in a breast cancer model system. J Biomol NMR 49, 185-193. WHO, 2009. Les femmes et la santé: la réalité d'aujourd'hui, le programme de demain, p. 104. Wiklund, S., Johansson, E., Sjostrom, L., Mellerowicz, E.J., Edlund, U., Shockcor, J.P., Gottfries, J., Moritz, T., Trygg, J., 2008. Visualization of GC/TOF-MS-based metabolomics data for identification of biochemically interesting compounds using OPLS class models. Anal Chem 80, 115-122. Williams, G.M., Kroes, R., Munro, I.C., 2000. Safety evaluation and risk assessment of the herbicide Roundup and its active ingredient, glyphosate, for humans. Regul Toxicol Pharmacol 31, 117-165. Wilson, A.K., Latham, J.R., Steinbrecher, R.A., 2006. Transformation-induced mutations in transgenic plants : Analysis and biosafety implications. Biotechnology and Genetic Engineering Reviews. 23, 209-237 Zhang, L., Hou, D., Chen, X., Li, D., Zhu, L., Zhang, Y., Li, J., Bian, Z., Liang, X., Cai, X., Yin, Y., Wang, C., Zhang, T., Zhu, D., Zhang, D., Xu, J., Chen, Q., Ba, Y., Liu, J., Wang, Q., Chen, J., Wang, J., Wang, M., Zhang, Q., Zhang, J., Zen, K., Zhang, C.Y., 2012. Exogenous plant MIR168a specifically targets mammalian LDLRAP1: evidence of cross-kingdom regulation by microRNA. Cell Res 22, 107-126. Zhou, J., Ma, C., Xu, H., Yuan, K., Lu, X., Zhu, Z., Wu, Y., Xu, G., 2009. Metabolic profiling of transgenic rice with cryIAc and sck genes: an evaluation of unintended effects at metabolic level by using GC-FID and GC-MS. J Chromatogr B Analyt Technol Biomed Life Sci 877, 725-732. Zolla, L., Rinalducci, S., Antonioli, P., Righetti, P.G., 2008. Proteomics as a complementary tool for identifying unintended side effects occurring in transgenic maize seeds as a result of genetic modifications. J Proteome Res 7, 1850-1861.
Source: http://tpe-ogm.fr/index_htm_files/etudeinvivoseralini.pdf
GLUE AND OTHER INHALANTS MARIJUANA AND HASHISH Twice as many people die from overdoses of Sniffing glue and inhaling other volatile Marijuana, hashish, and hashish oil come from a barbiturates as from overdoses of heroin. chemicals, such as deodorant, hair spray, or even plant called Cannabis. The dried, chopped leaves Barbiturates, sometimes called "barbs", "downs", or
Delatando a las mujeres: el deber de cada prestador/a de servicios de denunciar Implicaciones jurídicas y de derechos humanos para los servicios de salud reproductiva en Latinoamérica © Sara Gómez, Ipas istóricamente, la ética médica ha apoyado el secreto pro-fesional; en efecto, es un concepto fundamental del Jura-mento Hipocrático (Respetaré la privacidad de mis pacien-


